题目内容
14.如下四个装置可以实现反应Cu+H2SO4═CuSO4+H2↑的是( )| A. |  | B. |  | C. |  | D. |  |
分析 原电池中,铜作负极失去电子,正极上氢离子得电子生成氢气;电解池中,Cu作阳极失电子,阴极上氢离子得电子生成氢气,据此分析.
解答 解:把Cu+H2SO4═CuSO4+H2↑设计为电解池,Cu作阳极失电子生成铜离子,阴极上氢离子得电子生成氢气,所以Cu作阳极,其它电极作阴极,稀硫酸作电解质溶液;设计成原电池,Cu作负极失电子生成铜离子,正极上氢离子得电子生成氢气,
A、不能发生自发的氧化还原反应,故A错误;
B、为电解池,铜作阳极,银作阴极,满足条件,故B正确;
C、为电解池,银作阳极,不能满足条件,故C错误;
D、不能发生自发的氧化还原反应,故D错误;
故选B.
点评 本题考查了原电池、电解原理的应用,侧重于考查学生对基础知识的应用能力和设计实验方案的能力,注意把握原电池正负极反应和电解池中阴阳极上的反应,题目难度不大.

练习册系列答案
相关题目
5.下列实验操作正确的是( )
| A. |  测溶液pH | B. |  过滤 | C. |  稀释浓硫酸 | D. |  检查气密性 检查气密性 |
9.欲使醋酸溶液中的CH3COO-浓度增大,电离平衡向电离方向移动,且不放出气体,可向醋酸溶液中加入少量固体( )
| A. | NaOH | B. | NaHCO3 | C. | CH3COONa | D. | Na |
19.常温常压下,由三种气态烃以任意比例组成混合气体,现取体积为V的该混合气体与足量氧气混合,经点燃爆炸后恢复到原状况,气体总体积缩小了2V.混合烃的可能组合是( )
| A. | CH4C2H4C3H4 | B. | CH4C2H6C2H2 | C. | C2H2C2H4C3H6 | D. | C2H4C3H6C4H8 |
6.如图所示的锌、铜和稀硫酸组成的原电池,工作时下列说法正确的是( )
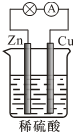

| A. | 反应一段时间后,溶液的酸性减弱 | |
| B. | 电子由Zn经外电路流向Cu,再经硫酸溶液流回Zn | |
| C. | 负极的反应式为2H++2e-═H2↑ | |
| D. | 硫酸作电解质起导电的作用,故浓度保持不变 |
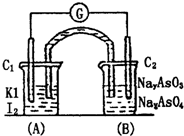 已知反应AsO43-+2I-+H+?AsO33-+I2+H2O是可逆反应.设计如图装置,进行下述操作:
已知反应AsO43-+2I-+H+?AsO33-+I2+H2O是可逆反应.设计如图装置,进行下述操作:
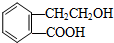 ,它可通过不同化学反应分别制得B、C、D和E四种物质
,它可通过不同化学反应分别制得B、C、D和E四种物质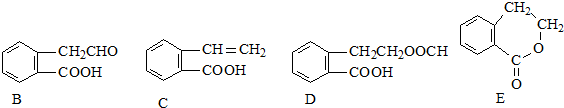
 ;A→D:
;A→D: .
. .
.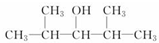 B.
B.
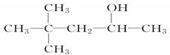 D.CH3(CH2)5CH2OH
D.CH3(CH2)5CH2OH