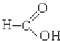
题目内容
室温下的溶液中,在强碱性溶液中不能大量共存的离子组是( )
| A、Ba2+、Na+、NO3-、Br- |
| B、K+、Na+、SO32-、S2- |
| C、K+、Na+、AlO2-、SO42- |
| D、NH4+、Cu2+、Cl-、NO3- |
考点:离子共存问题
专题:
分析:强碱性溶液中含大量的OH-,根据离子之间不能结合生成沉淀、水、气体等,则离子大量共存,以此来解答.
解答:
解:A、B、C中的离子组在强碱溶液中该组离子之间不反应,可大量共存,而D中Cu2+、OH-结合生成沉淀,不能大量共存,
故选D.
故选D.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
对于体积相同的①(NH4)2SO4、②NH4HSO4、③H2SO4溶液,下列说法正确的是( )
| A、溶液的pH相同时,3种溶液物质的量浓度大小顺序是③>②>① |
| B、溶液的pH相同时,将3种溶液稀释相同倍数,pH变化最大的是① |
| C、溶液的pH相同时,由水电离出的c(H+)大小顺序是③>②>① |
| D、若3种溶液的物质的量浓度都相同,则溶液的pH大小顺序是①>②>③ |
下列对合金描述不正确的是( )
| A、合金最多只能含有两种元素 |
| B、多数合金的硬度较大 |
| C、多数合金的熔点比成分金属低 |
| D、合金的性能跟合金元素的种类有关 |
已知:(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Br-+2Fe3+,由此可判断有关离子的还原性从强到弱的顺序是( )
| A、Br->Fe2+>I- |
| B、I->Fe2+>Br- |
| C、Br->I->Fe2+ |
| D、Fe2+>I->Br- |
下列化学用语的表达或使用正确的是( )
A、氟离子的结构示意图: |
B、CH4的比例模型: |
C、羧基的电子式: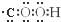 |
| D、NaHCO3的电离方程式:NaHCO3═Na++H++CO32- |
 ③
③ ④
④ ⑤
⑤ ⑥
⑥