题目内容
17. 控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )
控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )| A. | 反应开始时,B池中石墨电极上发生氧化反应 | |
| B. | 反应开始时,A池中石墨电极上I-被还原 | |
| C. | 反应开始时,盐桥中K+由左向右迁移 | |
| D. | 电流计读数为零后,在B池中溶入Na3AsO3固体,B池中的石墨电极为正极 |
分析 反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成原电池,As元素的化合价降低,I元素的化合价升高,则A中为负极发生的氧化反应,B中为正极发生的还原反应,以此来解答.
解答 解:A、A为负极,负极发生氧化反应,而B为正极发生还原反应,故A错误;
B、碘离子失去电子,发生氧化反应,被氧化,故B错误;
C、阳离子向正极移动,所以盐桥中K+由左向右迁移,故C正确;
D、当电流计为零时,达平衡状态,在B池中溶入Na3AsO3固体,平衡AsO43-+2I-+2H+? AsO33-+I2+H2O逆向移动,AsO33-失去电子,为负极,故D错误;
故选C.
点评 本题考查原电池,注意利用氧化还原反应来分析发生的电极反应,选项D为解答的难点,题目难度中等.

练习册系列答案
相关题目
1.下列推断不正确的是( )
| A. | 稳定性:HF>HCl>HBr>HI | B. | 氧化性:I2>Br2>Cl2 | ||
| C. | 沸点:H2O>NH3 | D. | 还原性:HI>HBr>HCl>HF |
12.已知NO与H2反应后生成1molN2和水蒸气时,放出665kJ热量,其反应机理为:①2NO=N2O2(快)②N2O2+H2=N2O+H2O(慢)③N2O+H2=N2+H2O(g)(快).下列说法正确的是( )
| A. | 整个过程的反应速率由反应②决定 | B. | N2O2,N2O是该反应的催化剂 | ||
| C. | 当$\frac{1}{2}$v(NO)=v(N2)时,反应达到平衡 | D. | 该反应的活化能为665kJ•mol-3 |
9.下列说法中,正确的是( )
| A. | 光导纤维、聚酯纤维、棉花都属于高分子化合物 | |
| B. | 在大米酿酒的过程中,淀粉最后变成了单糖 | |
| C. | 明矾和漂白粉处理自来水,二者的作用原理相同 | |
| D. | 合成顺丁橡胶( )的单体是CH2=CH-CH=CH2. )的单体是CH2=CH-CH=CH2. |
7.在下列条件下,能大量共存的离子组是( )
| A. | c(H+)=1×10-14mol/L的无色溶液:K+、S2-、MnO4-、SO42- | |
| B. | 水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 能使甲基橙变红的溶液中:Na+、NH4+、Fe2+、NO3- |

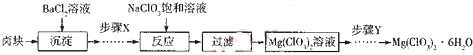
 .
.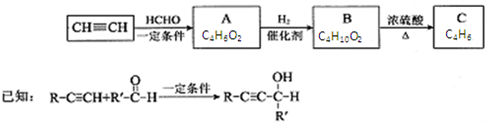
 ,其反应类型消去反应.
,其反应类型消去反应.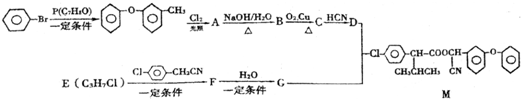
 .
.