题目内容
12.已知NO与H2反应后生成1molN2和水蒸气时,放出665kJ热量,其反应机理为:①2NO=N2O2(快)②N2O2+H2=N2O+H2O(慢)③N2O+H2=N2+H2O(g)(快).下列说法正确的是( )| A. | 整个过程的反应速率由反应②决定 | B. | N2O2,N2O是该反应的催化剂 | ||
| C. | 当$\frac{1}{2}$v(NO)=v(N2)时,反应达到平衡 | D. | 该反应的活化能为665kJ•mol-3 |
分析 A、若总反应由一系列快慢悬殊的连续步骤组成,总反应速率就决定于其中最慢的一步;
B、根据催化剂为参加反应,但反应前后质量和化学性质不变来判断;
C、根据正逆反应速率相等判断;
D、根据NO与H2反应后生成1molN2和水蒸气时,放出665kJ热量,则该反应的焓变为-665kJ•mol-1.
解答 解:A、若总反应由一系列快慢悬殊的连续步骤组成,总反应速率就决定于其中最慢的一步,②N2O2+H2=N2O+H2O(慢),所以总反应的速率主要取决于三步反应中的②,故A正确;
B、因为催化剂为参加反应,在反应前后质量和化学性质不变,所以N2O2,N2O仅仅是反应的中间产物,并不是催化剂,故B错误;
C、当$\frac{1}{2}$v(NO)=v(N2)时,未指明正逆方向,故C错误;
D、因为NO与H2反应后生成1molN2和水蒸气时,放出665kJ热量,则该反应的焓变为-665kJ•mol-1,故D错误;
故选:A.
点评 本题主要考查了化学反应的原理,涉及到若总反应由一系列快慢悬殊的连续步骤组成,总反应速率就决定于其中最慢的一步,催化剂的判断,平衡状态的判断等,难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
17.NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 L 2 mol•L-1的醋酸钠溶液中CH3COO- 的数目小于2NA | |
| B. | 常温常压下,1.12 L O2气体所含原子数为0.1NA | |
| C. | 将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA | |
| D. | 1 mol羟基含有的电子数为10NA |
14.关于元素周期表,下列叙述中不正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 周期表中位置靠近的元素性质相似 |
17. 控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )
控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )
 控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )
控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )| A. | 反应开始时,B池中石墨电极上发生氧化反应 | |
| B. | 反应开始时,A池中石墨电极上I-被还原 | |
| C. | 反应开始时,盐桥中K+由左向右迁移 | |
| D. | 电流计读数为零后,在B池中溶入Na3AsO3固体,B池中的石墨电极为正极 |
2.下列说法正确的是( )
| A. | 由H、N、O三种元素形成的化合物中一定含有共价键 | |
| B. | 正戊烷、异丁烷和丙烷属于同系物,沸点依次升高 | |
| C. | 葡萄糖能发生银镜反应,蔗糖、麦芽糖也能发生银镜反应 | |
| D. | 用KSCN溶液检验Fe3+的实验现象是产生血红色沉淀 |
 A、B、C为短周期元素,在周期表中所处的位置如右图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍.
A、B、C为短周期元素,在周期表中所处的位置如右图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍. .
. .
.
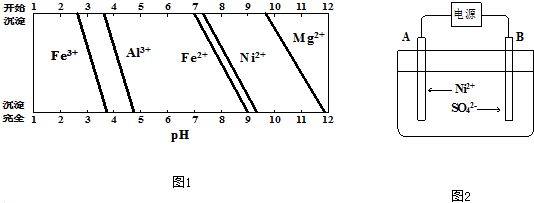
 甲醇脱氧制取甲醛的原理为CH3OH(g)?HCHO(g)+H2(g),某科研小组在1L恒溶密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示.
甲醇脱氧制取甲醛的原理为CH3OH(g)?HCHO(g)+H2(g),某科研小组在1L恒溶密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示.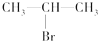 (主要产物),1mol某芳香烃A充分燃烧后可以得到8molCO2和4molH2O.该烃A在不同条件下能发生如下所示的一系列变化.
(主要产物),1mol某芳香烃A充分燃烧后可以得到8molCO2和4molH2O.该烃A在不同条件下能发生如下所示的一系列变化.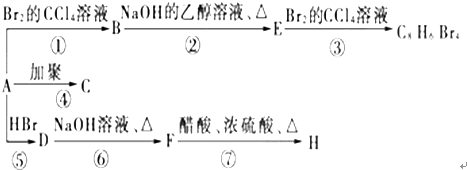
 ②的反应类型:消去反应
②的反应类型:消去反应 +CH3COOH$→_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$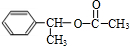 +H2O,反应类型:酯化(取代)反应
+H2O,反应类型:酯化(取代)反应