��Ŀ����
��8�֣�����þ��ҽ���Ͼ��������εȹ�Ч������þ����Ҫ�ɷ���MgCO3��Ϊ��Ҫԭ���Ʊ�����þ�ķ������£�

��1��������з�����Ӧ�����ӷ���ʽΪ ��
��2��������е���pH=6.0~6.5��Ŀ���� ��
��3������ݵIJ���Ϊ
��4����֪���ָʾ�����������ɫ��pH��Χ�����ʾ��
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
��ɫ | ��ɫ | ��ɫ | ��ɫ |
25��ʱ����Mg(OH)2�ı�����Һ�еμ�2�ΰ������ָʾ������Һ�����ֵ���ɫ
Ϊ [25��ʱ��Ksp[Mg(OH)2] =5.6��10-12]��
��8�֣�
��1��2NH4+ + MgO��Mg2+ + 2NH3��+ H2O ��2�֣�
��2������Mg2+ˮ�⣬�Ա�õ���������IJ�Ʒ ��2�֣�
��3������Ũ������ȴ�ᾧ��2�֣�
��4����ɫ��2�֣�
��������
�����������1��MgO���������Һ���ȷ�Ӧ���ɵ����������ᷴӦ��������泥�˵���������ǰ�������MgO������識��ȵIJ������а�����˵��MgO�ļ��룬�ٽ�笠����ӵ�ˮ�⣬���ɰ������õ�����������MgO��Ӧ����þ���Ӻ�ˮ�����Բ�����з�����Ӧ�����ӷ���ʽΪ2NH4+ + MgO��Mg2+ + 2NH3��+ H2O��
��2���õ�������þ��Һ��þ����ˮ�⣬�ò����ϴ�������þ��������Ϊ����þ����ˮ�⣬������е���pH=6.0~6.5���Ա�õ���������IJ�Ʒ��
��3������Һ�õ���������еIJ���������Ũ������ȴ�ᾧ�����Բ���ݵIJ���Ϊ����Ũ������ȴ�ᾧ��
��4�����͵�������þ��Һ����Mg(OH)2 ��s��= Mg2+��aq�� + 2 OH-��aq���ܽ�ƽ�⣬2c��Mg2+��= c��OH -�������ܶȻ�Ksp= c��Mg2+��c2��OH -��=5.6��10-12 ���ɴ˿��Եó�c��OH -��=2.24��10-4 ��c��H+��=1��10-14/2.24��10-4 =4.5��10-11������pH>9.6�����Լ���������ָʾ������Һ����ɫ��
���㣺����þ���仯�������ʵ�Ӧ�ã��Թ�ҵ���̵ķ���������������жϣ��ܶȻ��ļ���

 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д� ��
�� ����������ͬ ������
����������ͬ ������ �������������
�������������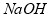 �Ĺ�������ʾ��ͼ���£�
�Ĺ�������ʾ��ͼ���£�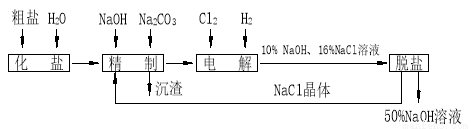
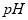 ֵ___________����ѡ����䡢�����½���
ֵ___________����ѡ����䡢�����½���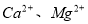 �����ʣ����ƹ��̷�����Ӧ�����ӷ���ʽΪ____________________________________________��
�����ʣ����ƹ��̷�����Ӧ�����ӷ���ʽΪ____________________________________________��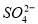 �����ϸߣ��������ӱ��Լ���ȥ
�����ϸߣ��������ӱ��Լ���ȥ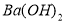 b.
b. 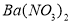 c.
c. 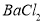
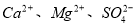 �������Լ��ĺ���˳��Ϊ_____________��ѡ��a��b��c��ѡ���۷֣�
�������Լ��ĺ���˳��Ϊ_____________��ѡ��a��b��c��ѡ���۷֣�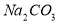 ���ټӱ��Լ�
���ټӱ��Լ�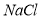 ���ܽ���ϵIJ��죬ͨ��____________����ȴ��______________����д�������ƣ���ȥ
���ܽ���ϵIJ��죬ͨ��____________����ȴ��______________����д�������ƣ���ȥ ��
��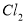 ��
��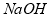 ��Ӧ��������Ĥ������ʳ��ˮʱ��
��Ӧ��������Ĥ������ʳ��ˮʱ��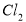 ��
��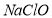 ��
�� ����Ӧ�Ļ�ѧ����ʽΪ_____________________��
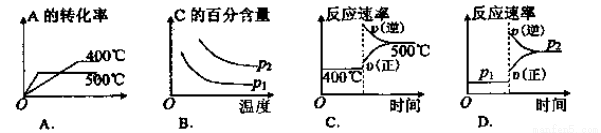
����Ӧ�Ļ�ѧ����ʽΪ_____________________�� 2C(g)�������±��е������ж�����ͼ��������( )
2C(g)�������±��е������ж�����ͼ��������( )
 Mgx Mo3S4 ������˵��������ǣ� ��
Mgx Mo3S4 ������˵��������ǣ� ��
 O2
O2