题目内容
18.在一定量的硫酸铜溶液中,放入8.4g铁片反应一段时间后,将铁片取出洗净干燥后称量,铁片质量为9.2g,则析出了0.1molCu?剩余的铁片最少需要含0.1;molHCl的盐酸才能完全溶解,并产生0.05mol气体?分析 铁和硫酸铜反应生成硫酸亚铁和铜,根据铁片增加的质量可以计算反应的铁的质量,根据金属铁和盐酸之间的反应进行计算.
解答 解:设参加反应的铁的质量为x,析出金属铜的质量是y,
Fe+CuSO4═FeSO4+Cu,铁片增加的质量
56 64 64-56=8
x y 9.2g-8.4g=0.8g
$\frac{56}{x}=\frac{8}{0.8}$=$\frac{64}{y}$,解得x=5.6g,y=6.4g,析出金属铜物质的量是$\frac{6.4g}{64g/mol}$=0.1mol,剩余的铁片质量是8.4g-5.6g=2.8g,物质的量是0.05mol,设产生氢气物质的量是z,
Fe+2HCl=FeCl2+H2↑
1 2 1
0.05mol 0.1mol 0.05mol
所以产生气体0.05mol,消耗盐酸是0.1mol,故答案为:0.1;0.1;0.05.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求.

练习册系列答案
相关题目
8.下列离子方程式表达正确的是( )
| A. | 向硫酸铵溶液中滴加氢氧化钡溶液:Ba2++SO42-=BaSO4↓ | |
| B. | 钠跟水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | AlCl3溶液中加入过量氨水:Al3++4NH3.H2O=AlO2-+4NH4++2H2O | |
| D. | 用NaOH溶液吸收少量Cl2:Cl2+2OH-=Cl-+ClO-+H2O |
6.在NO2被水吸收的反应中,发生还原反应和发生氧化反应的物质,其质量比为( )
| A. | 1:1 | B. | 1:3 | C. | 1:2 | D. | 4:1 |
13.不能用浓硫酸干燥的气体是( )
| A. | NH3 | B. | SO2 | C. | Cl2 | D. | HCl |
3.实验室常用氯化铵与氢氧化钙的固体混合物加热制取氨气,该反应的化学方程式为:2NH4Cl+Ca(OH)2$\stackrel{△}{→}$CaCl2+2NH3↑+2H2O.下列是实验室提供的有关装置:
(1)请从图中选择实验室制取氨气的气体发生装置b(填序号)、气体收集装置①(填序号).
(2)某学生用100mL注射器收集了50mL纯净的氨气,然后再抽取10mL滴有酚酞试液的蒸馏水,并用橡皮塞封闭针头.充分振荡后,注射器内无(填“有”或“无”)气体剩余,其中的液体呈红色,请用方程式解释液体颜色变化的原因:NH3+H2O?NH3•H2O?NH4++OH-.
(3)氨具有广泛的用途,它可用于制造化肥/制造硝酸/作冷却剂(举出一种即可).工业上合成氨常常要用铁触媒作催化剂,所加催化剂能否提高N2的转化率不能.理由是催化剂只改变化学反应速率,不影响平衡移动.
(4)工业合成氨的简易流程如下:

通过循环Ⅰ可利用的气态物质是D
A.催化剂 B.只有N2C.只有H2 D.N2和H2.
| 气体发生装置 | 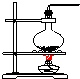 a |  b | 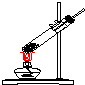 c |
| 气体收集装置 | 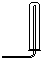 ① |  ② | 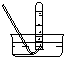 ③ |
(2)某学生用100mL注射器收集了50mL纯净的氨气,然后再抽取10mL滴有酚酞试液的蒸馏水,并用橡皮塞封闭针头.充分振荡后,注射器内无(填“有”或“无”)气体剩余,其中的液体呈红色,请用方程式解释液体颜色变化的原因:NH3+H2O?NH3•H2O?NH4++OH-.
(3)氨具有广泛的用途,它可用于制造化肥/制造硝酸/作冷却剂(举出一种即可).工业上合成氨常常要用铁触媒作催化剂,所加催化剂能否提高N2的转化率不能.理由是催化剂只改变化学反应速率,不影响平衡移动.
(4)工业合成氨的简易流程如下:

通过循环Ⅰ可利用的气态物质是D
A.催化剂 B.只有N2C.只有H2 D.N2和H2.