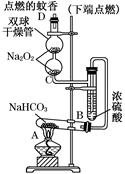
题目内容
铝是一种应用广泛的金属,工业上用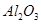 和冰晶石(
和冰晶石(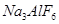 )混合熔融电解制得。
)混合熔融电解制得。
①铝土矿的主要成分是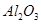 和
和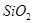 等。从铝土矿中提炼
等。从铝土矿中提炼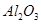 的流程如下:
的流程如下: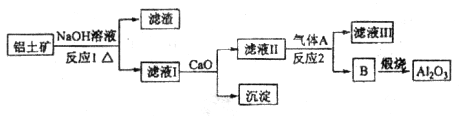
②以萤石(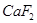 )和纯碱为原料制备冰晶石的流程如下:
)和纯碱为原料制备冰晶石的流程如下: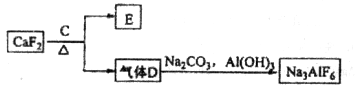
回答下列问题:
(1)写出反应1的化学方程式_________________________、________________________________;
(2)滤液Ⅰ中加入 生成的沉淀是___________,反应2的离子方程式为____ ___________________
生成的沉淀是___________,反应2的离子方程式为____ ___________________
(3)E常用作制作豆腐的添加剂,化合物C是____,写出由D制备冰晶石的化学方程式_______________;
(1)2NaOH+SiO2=Na2SiO3+H2O 2NaOH+Al2O3=2NaAlO2+H2O
(2)CaSiO3(2分) 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-(2分)
(3)浓H2SO4(1分) 12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O(2分)
解析试题分析:由铝土矿的成分及流程图分析知,第一步发生的反应为氧化铝、二氧化硅和氢氧化钠溶液反应,2NaOH+Al2O3=2NaAlO2+H2O;2NaOH+SiO2=Na2SiO3+H2O,滤渣成分为二氧化硅,滤液I的主要成分是NaAlO2和Na2SiO3,加入生石灰发生的反应:CaO+H2O=Ca(OH)2和Ca(OH)2 +Na2SiO3=CaSiO3+ 2NaOH,即沉淀为CaSiO3。滤液II的主要成分是NaAlO2,通入的气体A是CO2,发生反应的方程式为2NaAlO2+CO2+3H2O=2A l ( O H )3↓+Na2CO3;物质B为氢氧化铝,煅烧的氧化铝。由上述分析知,(1)反应1的化学方程式为2NaOH+SiO2=Na2SiO3+H2O,2NaOH+Al2O3=2NaAlO2+H2O;(2)滤液I的主要成分是NaAlO2和Na2SiO3,加入生石灰发生的反应:CaO+H2O=Ca(OH)2和Ca(OH)2 +Na2SiO3=CaSiO3+ 2NaOH,即沉淀为CaSiO3。滤液II的主要成分是NaAlO2,通入的气体A是CO2,发生反应的方程式为2NaAlO2+CO2+3H2O=2A l ( O H )3↓+Na2CO3;(3)根据E常用作制作豆腐的添加剂,为硫酸钙,加入C能和CaF2 发生反应生成硫酸钙,可知C是浓硫酸,反应的方程式为CaF2+H2SO4(浓) CaSO4+2HF;气体D为氟化氢,根据题给信息写出方程式为12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O。
CaSO4+2HF;气体D为氟化氢,根据题给信息写出方程式为12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O。
考点:以化学工艺流程为载体考查常见物质的性质及化学方程式的书写。

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案由废铁制备FeCl2的主要过程如下:
Ⅰ.按下图所示过程制备FeCl3?6H2O 
(1)①中产生气体的电子式是 。
(2)用离子方程式表示过程②中稀硝酸的作用 ,在该过程中要不断向溶液中补充盐酸,目的是 。
Ⅱ.由FeCl3 ? 6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3 ? 6H2O的容器中加入SOCl2,加热,获得无水FeCl3
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3) SOCl2与水接触会迅速产生白雾和SO2。加热分解FeCl3 ? 6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因 。
(4)过程ⅱ中产生FeCl2的化学方程式是 。
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性…… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
(5)下列说法正确的是 。
a.密闭保存、远离火源
b.可以与强氧化剂共同存放、运输
c.不宜用铁制容器包装而要用聚乙烯塑料桶包装
(6)FeCl2在空气中受热可生成氯化铁、氧化铁等,反应的化学方程式是 。



 k+s-5#
k+s-5# NaHCO3↓+NH4Cl,处理母液的两种方法如下:
NaHCO3↓+NH4Cl,处理母液的两种方法如下: