题目内容
为阿伏伽德罗常数,下列叙述错误的是( )
| A、标准状况下,11.2 L氢气中含有1 mol质子 |
| B、12g金刚石含有的共价键数为4NA |
| C、46g NO2和N2O4混合气体中含有原子总数为3NA |
| D、1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、标准状况下,11.2L氢气的物质的量为0.5mol,0.5mol氢气中含有1mol质子;
B、金刚石晶体中,1个C原子与其它4个C形成4个共价键,利用均摊法计算出12g金刚石中含有的共价键数目;
C、NO2和N2O4的最简式为NO2,46g混合物中含有1mol最简式,含有3mol原子;
D、钠为1价金属,1mol钠完全反应失去1mol电子.
B、金刚石晶体中,1个C原子与其它4个C形成4个共价键,利用均摊法计算出12g金刚石中含有的共价键数目;
C、NO2和N2O4的最简式为NO2,46g混合物中含有1mol最简式,含有3mol原子;
D、钠为1价金属,1mol钠完全反应失去1mol电子.
解答:
解:A、标准状况下,11.2L氢气的物质的量为0.5mol,含有1mol氢原子,含有1mol质子,故A正确;
B、12g金刚石中含有1molC,1molC可以与其它碳原子形成4mol碳碳共价键,所以1molC形成的共价键为:
×4mol=2mol,含有的共价键数为2NA,故B错误;
C、46g NO2和N2O4混合气体中含有1mol最简式NO2,含有1molN、2molH,总共含有3mol原子,含有原子总数为3NA,故C正确;
D、1 mol Na与足量O2反应,无论生成Na2O还是Na2O2,1mol钠完全反应失去了1mol电子,钠失去NA个电子,故D正确;
故选B.
B、12g金刚石中含有1molC,1molC可以与其它碳原子形成4mol碳碳共价键,所以1molC形成的共价键为:
| 1 |
| 2 |
C、46g NO2和N2O4混合气体中含有1mol最简式NO2,含有1molN、2molH,总共含有3mol原子,含有原子总数为3NA,故C正确;
D、1 mol Na与足量O2反应,无论生成Na2O还是Na2O2,1mol钠完全反应失去了1mol电子,钠失去NA个电子,故D正确;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;选项B为易错点,注意明确金刚石的结构及均摊法的应用.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
己知:25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgCN)=1.2×10-16.下列说法正确的是( )
| A、25℃时,饱和AgCN溶液与饱和AgCl溶液相比,前者的c(Ag+)大 |
| B、25℃时,向AgCl的悬浊液中加入少量NaCN固体,c(Cl-)增大 |
| C、25℃时,AgCN固体在20mL 0.01mol?L-1 NaCN溶液中的Ksp比在20mL 0.01mol?L-1 HCN(弱酸)溶液中的Ksp小 |
| D、25℃时,向AgCl的饱和溶液中加入足量浓AgNO3溶液,溶液中各离子浓度不变 |
下列离子组能大量共存的是( )
| A、Ba2+、K+、Cl-、SO42- |
| B、Mg2+、Na+、MnO4-、I- |
| C、H+、Al3+、CO32-、Cl |
| D、H+、Fe3+、NO3-、SO42- |
下列离子方程式的书写正确的是( )
| A、SiO2与NaOH溶液反应:SiO2+2Na++2OH-=Na2SiO3+H2O |
| B、浓烧碱溶液中加入铝片:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| C、铁和稀硝酸反应:Fe+2H+=Fe2++H2↑ |
| D、Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- |
下列表示对应化学反应的离子方程式.其中正确的是( )
| A、向NaAlO2溶液中通入足量的CO2:A1O2-+CO2+2H2O═A1(OH)3↓+HCO3- |
| B、(NH4)2Fe(SO4)2溶液中加入过量的氢氧化钡溶液:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3?H2O |
| C、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O |
| D、工业上用氨水吸收二氧化硫:2OH-+SO2═SO32-+H2O |
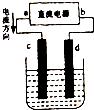 图是电解CuCl2溶液的装置,其中c、d为石墨电极.
图是电解CuCl2溶液的装置,其中c、d为石墨电极. 已知25℃、101kPa下,氢气、甲烷和葡萄糖C6H12O6(S)的燃烧热依次为285.8kJ/mol、890.3kJ/mol、2800kJ/mol.
已知25℃、101kPa下,氢气、甲烷和葡萄糖C6H12O6(S)的燃烧热依次为285.8kJ/mol、890.3kJ/mol、2800kJ/mol.