题目内容
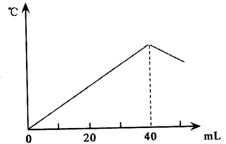
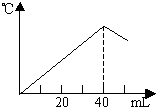 运用中和热的测定方法,在绝对保温、隔热的条件下,向20mL2.08mol/L的NaOH溶液中逐滴加入未知浓度的H2SO4(边加边充分搅拌)后,测得溶液的温度与滴加H2SO4溶液体积关系如图所示,则该H2SO4溶液的物质的量浓度约是( )
运用中和热的测定方法,在绝对保温、隔热的条件下,向20mL2.08mol/L的NaOH溶液中逐滴加入未知浓度的H2SO4(边加边充分搅拌)后,测得溶液的温度与滴加H2SO4溶液体积关系如图所示,则该H2SO4溶液的物质的量浓度约是( )| A、2.08mol/L | B、1.04mol/L | C、4.16mol/L | D、0.52mol/L |
分析:当氢氧化钠与硫酸恰好反应时,放出的热量最多,溶液的温度达到最高,据此可以判断氢氧化钠消耗的硫酸溶液的体积,再根据反应方程式计算出40mL硫酸溶液中含有的溶质硫酸的物质的量,最后根据c=
计算出硫酸的物质的量浓度.
| n |
| V |
解答:解:发生的反应为2NaOH+H2SO4=Na2SO4+2H2O,中和反应为放热反应,故反应过程中温度不断升高,而当V(H2SO4)=40mL时,温度开始降低,说明此时反应已经完全,所以n(H2SO4)=
n(NaOH)=
=0.0208mol,所以,硫酸的浓度为c(H2SO4)=
=0.52mol/L,
故选D.
| 1 |
| 2 |
| 0.020L×2.08mol/L |
| 2 |
| 0.0208mol |
| 0.040L |
故选D.
点评:本题考查了物质的量浓度的简单计算、中和热图象分析,题目难度中等,解题关键是合理分析图象中温度变化的原因及意义,据此判断出氢氧化钠与硫酸恰好反应时关系,试题培养了学生的分析、理解能力.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目