题目内容
(14分)铜及其化合物在生产、生活中有广泛的应用。
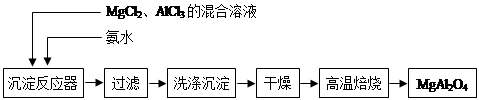
Ⅰ、铜可采用如下方法制备:
方法一:火法炼铜:Cu2S + O2 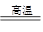 2Cu + SO2
2Cu + SO2
方法二:湿法炼铜:CuSO4 + Fe FeSO4 + Cu
FeSO4 + Cu
上述两种方法中,你认为哪种方法更好 ,原因是 (写出1条原因即可)。分别用火法炼铜与湿法炼铜生产640gCu,则转移的电子数之比为 。
Ⅱ、印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O晶体,实验室模拟回收过程如下: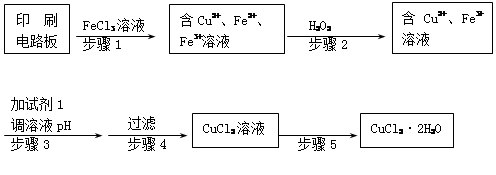
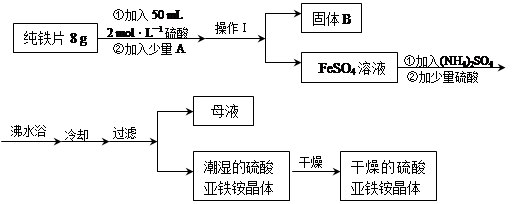
①步骤2中反应的离子方程式是 。
②步骤5中蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________________ (用化学方程式并结合简要文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O晶体。
③步骤4中洗涤沉淀的操作为
④步骤3中可选用的“试剂1”是 (写出一种即可),目的是使溶液的pH升高到4,此时Fe3+浓度为 [Ksp(Fe(OH)3)=4×10-38]。
Ⅰ湿法炼铜(或方法二)不会产生污染空气的气体(或湿法炼铜不需要外界提供能量); 3:2
Ⅱ ① 2Fe2++ H2O2 +2H+ = 2Fe3+ + 2H2O
②CuCl2在溶液中可以发生水解反应: CuCl2+2H2O Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解
Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解
③ 向漏斗中加少量蒸馏水(水)至没过沉淀,静置滤干后重复操作2~3次。
④ CuO[或Cu(OH)2] ; 4×10-8mol/L
解析

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案下列实验叙述正确的是( )
| A.新制氯水放置数天,溶液中的Cl2分子数目不变 |
| B.久置的氯水可使蓝色石蕊试纸先变红后褪色 |
| C.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 |
| D.钠投入硫酸铜溶液中有红色粉末产生 |
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色非氯净水消毒剂和高容量电池材料。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下: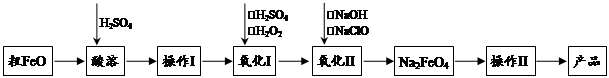
已知:NaClO不稳定,受热易分解。回答下列问题:
(1)高铁酸钠(Na2FeO4)中铁元素的化合价为 。
粗FeO酸溶过程中通入高温水蒸气,其目的是 。
(2)操作Ⅰ目的是得到高纯度FeSO4溶液,氧化Ⅰ后的溶液中如果滴加KSCN溶液,溶液变为血红色,由此推测氧化Ⅰ反应的离子方程式为 。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备:
①Cl2与NaOH溶液反应的化学方程式为_____________________________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/0C | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
_______________________________________________________________________________________。
蛇纹石是一种富镁硅酸盐矿物的总称,因其颜色青绿相间酷似蛇皮而得名。蛇纹石可以看作由MgO、FeO和Fe2O3、Al2O3、SiO2组成。工业上由蛇纹石制取碱式碳酸镁产品的流程如下:
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+、Al3+外,还含有的金属离子是________。
(2)向Ⅰ中加入H2O2的作用是 ,有关离子方程式 ,加入Ca(OH)2时, 需要控制溶液pH在7~8之间(有关氢氧化物沉淀的pH见下表)。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(3)沉淀物A可作为提取红色颜料的原料,若向沉淀物A中加入 溶液,然后过滤、洗涤、 _________(填写实验操作名称),即可获得红色颜料,实现废物的综合利用。
(4)若产品的化学式用aMgCO3·bMg(OH)2·cH2O表示,现称取18.2 g产品并使之完全分解,收集到3.36L CO2(标准状况下)和8.0 g MgO,通过计算确定产品的化学式中:a=________,b=________,c=________。
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:___________________________
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A、Ba(OH)2溶液 B、BaCl2溶液 C、NaOH溶液 D、澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 (填“甲”或“乙”)判断正确。
(3)常温下,在测得PH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH—浓度分别为amol /L和bmol /L,则a与b的比值= 。