题目内容
实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.
(1)该反应的氧化剂是 ,氧化产物是 ,用双线桥法表示上述反应电子转移方向和数目.
(2)计算当有73.0克HCl完全参加反时,消耗MnO2的物质的量为多少?生成的气体在标准状况下的体积多少升?
| ||
(1)该反应的氧化剂是
(2)计算当有73.0克HCl完全参加反时,消耗MnO2的物质的量为多少?生成的气体在标准状况下的体积多少升?
考点:氧化还原反应的计算,氧化还原反应的电子转移数目计算,氧化还原反应
专题:氧化还原反应专题
分析:反应MnO2+4HCl═MnCl2+Cl2+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,结合电子转移相等解答.
解答:
解:(1)反应MnO2+4HCl═MnCl2+Cl2+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,Cl2为氧化产物,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为2,用“双线桥法”表示氧化还原反应中电子转移情况为: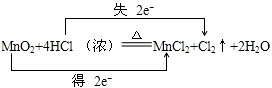 ,
,
故答案为:MnO2;Cl2; ;
;
(2)n(HCl)=
=2mol,
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
1mol 4mol 22.4L
n 2mol V
n=0.5mol,V=11.2L,
答:当有73.0克HCl完全参加反时,消耗MnO2的物质的量为0.5mol,生成的气体在标准状况下的体积11.2升.
 ,
,故答案为:MnO2;Cl2;
 ;
;(2)n(HCl)=
| 73g |
| 36.5g/mol |
MnO2+4HCl(浓)
| ||
1mol 4mol 22.4L
n 2mol V
n=0.5mol,V=11.2L,
答:当有73.0克HCl完全参加反时,消耗MnO2的物质的量为0.5mol,生成的气体在标准状况下的体积11.2升.
点评:本题考查氧化还原反应,侧重于学生的分析能力的考查,为高考高频考点和常见题型,注意从元素化合价的角度分析,难度不大.

练习册系列答案
相关题目
下列各组离子中,在溶液中能大量共存 的是( )
| A、Na+、Ca2+、CO32- |
| B、Na+、Ca2+、HCO3- |
| C、H+、SO42-、OH- |
| D、H+、Na+、CO32- |
在一定温度下向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应X(g)+Y(g)?2Z(g),此反应达到平衡的标志是( )
| A、容器内压强不随时间变化 |
| B、容器内各物质的浓度不随时间变化 |
| C、容器内X、Y、Z的浓度之比为1:1:2 |
| D、单位时间内消耗0.1 mol X同时生成0.2 mol Z |
有一关于实验操作的谜语:“我入水中较安全,水入我中真危险,我与水合多放热,实验牢记保平安.”这一实验操作是指( )
| A、蔗糖溶于水中 |
| B、氢氧化钠溶于水 |
| C、用压强计测某一深度处的水压 |
| D、稀释浓硫酸 |
莽草酸可用于合成药物达菲,其结构简式如图所示,下列关于莽草酸的说法正确的( )
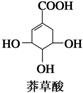

| A、能使FeCl3溶液显色 |
| B、分子中含有2种官能团 |
| C、可发生加成和取代反应 |
| D、分子中所有原子可以共平面 |