题目内容
19.下列有关甲烷的说法中,不正确的是( )| A. | 不能使酸性高锰酸钾溶液褪色 | B. | 可以用排水法或向下排空气法收集 | ||
| C. | 是最简单的有机物 | D. | 能使溴水褪色 |
分析 甲烷是最简单的有机物,甲烷密度大于空气且常温下和空气不反应,甲烷中不含碳碳不饱和键,性质较稳定,不和强酸、强碱、强氧化剂反应,据此分析解答.
解答 解:A.甲烷性质较稳定,不和强酸、强碱、强氧化剂反应,所以不能被酸性高锰酸钾溶液氧化,则不能使酸性高锰酸钾溶液褪色,故A正确;
B.甲烷密度小于空气,且不易溶于水,常温下不和空气反应,所以可以用排水法或向下排空气法收集,故B正确;
C.甲烷为空间正四面体结构,是最简单的有机物,故C正确;
D.甲烷中不含碳碳不饱和键,不能和溴水反应,所以不能使溴水褪色,故D错误;
故选D.
点评 本题以甲烷为载体考查有机物结构和性质,为高频考点,以甲烷为例掌握烷烃的性质,熟练掌握常见有机物性质及反应类型、反应条件,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列物质在溶于水和熔化时,破坏的作用力完全相同的是( )
| A. | HCl | B. | 冰醋酸 | C. | NaHSO4 | D. | KOH |
10.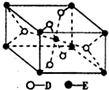 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.
(2)B、C、D三种元素的第一电离能由小到大的顺序为C<O<N.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a. M是极性分子,N是非极性分子
b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键
d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECl4和BD气体的热化学方程式:
TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)=2CA3(g)△H<0,其化学平衡常数K与温度t的关系如表.请回答下列问题.
①试比较K1,K2的大小,K1>K2(填写“>”、“=”或“<”).
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(C2)正>(C2)逆(填写“>”、“=”或“<”).
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为
 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.(2)B、C、D三种元素的第一电离能由小到大的顺序为C<O<N.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a. M是极性分子,N是非极性分子
b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键
d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECl4和BD气体的热化学方程式:
TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)=2CA3(g)△H<0,其化学平衡常数K与温度t的关系如表.请回答下列问题.
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(C2)正>(C2)逆(填写“>”、“=”或“<”).
14.下列对0.5molN2叙述正确的是( )
| A. | 含0.5mol氮原子 | B. | 含1个氮分子 | ||
| C. | 约含6.02×1023个氮分子 | D. | 其质量是14g |
4.下列无色透明溶液,能大量共存的是( )
| A. | K+、Na+、HCO3-、OH- | B. | Cl-、MnO4-、K+、Na+ | ||
| C. | SO42-、K+、Cl-、NO3- | D. | H+、NO3-、AlO2-、CO32- |
8.用氯气制漂白粉的主要目的是( )
| A. | 提高氯的质量分数 | B. | 增强漂白能力 | ||
| C. | 转变为很易溶于水的物质 | D. | 转变为较稳定,便于贮存的物质 |
 ③CH3CH2Br④
③CH3CH2Br④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ ⑩
⑩
 表示的有机物的分子式C6H14;
表示的有机物的分子式C6H14; 中含有的官能团的名称为酚羟基、酯基.
中含有的官能团的名称为酚羟基、酯基.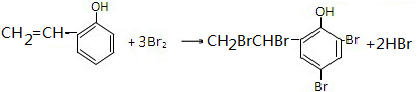 .
.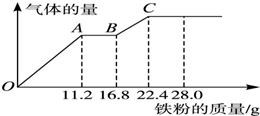 某稀硫酸和稀硝酸的混合溶液200mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.
某稀硫酸和稀硝酸的混合溶液200mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.