题目内容
在温度为500℃、压强为1.01×![]() Pa,把2体积
Pa,把2体积![]() 和1体积
和1体积![]() 组成的混合气,通入一个装有催化剂的密闭容器里,达到平衡时能得到含91%(体积组成)
组成的混合气,通入一个装有催化剂的密闭容器里,达到平衡时能得到含91%(体积组成)![]() 的混合气体.若在相同条件下,把2体积
的混合气体.若在相同条件下,把2体积![]() 通入一个装有催化剂的相同的密闭容器里,达到平衡时,在混合气体中
通入一个装有催化剂的相同的密闭容器里,达到平衡时,在混合气体中![]() 体积分数可能是
体积分数可能是
[ ]

 应用题作业本系列答案
应用题作业本系列答案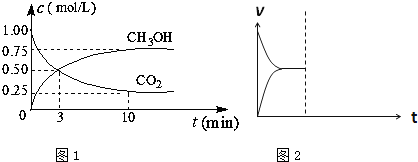
(1)在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol?L-1,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从0min到10min,v(H2)=
②能说明上述反应达到平衡状态的是
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是
A.将H2O(g)从体系中分离B.恒温恒容充入He
C.恒温恒压充入He D.恒温恒容再充入1mol CO2和3mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实.2CO2(g)+6H2(g)
| 催化剂 |
| 温度/k CO2转化率% |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
①反应的温度升高,K值
②提高氢碳比[n(H2)/n(CO2)],K值
(3)800℃时,C(s)+CO2(g)?2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20mol?L-1、c(CO2)=0.05mol?L-1,此时反应向
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)?CO(g)+H2O(g)△H>0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在图2中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图.
(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1)将水蒸气通过红热的炭即产生水煤气:
C(s) + H2O(g)  H2(g) + CO(g) △H =" +131.3" kJ ,△S =" +133.7" J/K
H2(g) + CO(g) △H =" +131.3" kJ ,△S =" +133.7" J/K
该反应在低温下能否自发 (填:能或否)。
(2)合成氨工业中原料气压缩到30~50MPa的原因是 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
(3)已知在400℃时,N2 (g)+ 3H2(g) 2NH3(g) 的K=0.5。
2NH3(g) 的K=0.5。
①在400℃时, 2NH3(g) N2 (g)+ 3H2(g)的K= (填数值)。
N2 (g)+ 3H2(g)的K= (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。
③500℃、50MPa时,在容积为2L的容器中加入1 mol N2、3mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K= 。
④在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号)。
| A.图Ⅰ可能是不同压强对反应的影响,且P2>P1 |
| B.图Ⅱ可能是不同压强对反应的影响,且P1>P2 |
| C.图Ⅲ可能是不同温度对反应的影响,且T1>T2 |
| D.图Ⅱ可能是同温同压下,催化剂性能:1>2 |
在一密闭容器中发生可逆反应2A(g)+B(g)
 2C(g),下表为反应在不同压强和温度下物质A的平衡转化率,有关说法正确的是(
)
2C(g),下表为反应在不同压强和温度下物质A的平衡转化率,有关说法正确的是(
)
|
温度 |
P1(Mpa) |
P2(Mpa) |
|
400℃ |
99.6% |
99.7% |
|
500℃ |
96.9% |
97.8% |
A.物质B可以是气态,也可以是非气态
B.P1>P2
C.该反应为吸热反应
D.若反应在恒压为B,初始温度为400℃下的绝热密闭容器中进行,平衡时A的转化率小于0.996

 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)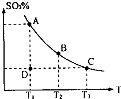 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题: A转化率
压强
A转化率
压强