题目内容
CO2可转化成有机物实现碳循环.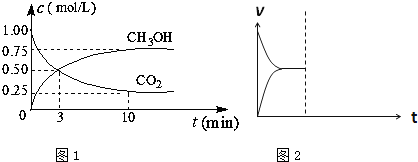
(1)在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol?L-1,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从0min到10min,v(H2)=
②能说明上述反应达到平衡状态的是
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是
A.将H2O(g)从体系中分离B.恒温恒容充入He
C.恒温恒压充入He D.恒温恒容再充入1mol CO2和3mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实.2CO2(g)+6H2(g)
| 催化剂 |
| 温度/k CO2转化率% |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
①反应的温度升高,K值
②提高氢碳比[n(H2)/n(CO2)],K值
(3)800℃时,C(s)+CO2(g)?2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20mol?L-1、c(CO2)=0.05mol?L-1,此时反应向
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)?CO(g)+H2O(g)△H>0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在图2中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图.
分析:(1)①由图象可知v(CO2),根据反应速率之比等于化学计量数之比计算氢气的反应速率;
②A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点),浓度相等而不是不变;
B.容器内气体的压强不随时间的变化而变化,说明正逆反应速率相等;
C.单位时间内每消耗3mol H2,同时生成1mol H2O,从反应开始到平衡始终相等,故不一定平衡;
D.CO2的体积分数在混合气体中保持不变,说明正逆反应速率相等;
③为使甲醇与二氧化碳的物质的量比值增大,应使平衡向正反应方向移动,或增加甲醇的物质的量;
(2)①任一组数据温度升高二氧化碳的转化率再减小,正反应为放热反应,温度越高K值越小;
②提高氢碳比[n(H2)/n(CO2)],温度未变,K值不变;
(3)比较浓度商与平衡常数之间的大小关系;
(4)当反应达到平衡后,在其他条件不变时,若升高温度,正逆反应速率都变大,正反应变化的幅度更大.
②A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点),浓度相等而不是不变;
B.容器内气体的压强不随时间的变化而变化,说明正逆反应速率相等;
C.单位时间内每消耗3mol H2,同时生成1mol H2O,从反应开始到平衡始终相等,故不一定平衡;
D.CO2的体积分数在混合气体中保持不变,说明正逆反应速率相等;
③为使甲醇与二氧化碳的物质的量比值增大,应使平衡向正反应方向移动,或增加甲醇的物质的量;
(2)①任一组数据温度升高二氧化碳的转化率再减小,正反应为放热反应,温度越高K值越小;
②提高氢碳比[n(H2)/n(CO2)],温度未变,K值不变;
(3)比较浓度商与平衡常数之间的大小关系;
(4)当反应达到平衡后,在其他条件不变时,若升高温度,正逆反应速率都变大,正反应变化的幅度更大.
解答:解:(1)①由图象可知v(CO2)=
=0.075mol/(L?min),根据反应速率之比等于化学计量数之比可知v(H2)=3v(CO2)=3×0.075mol/(L?min)=0.225 mol/(L?min),故答案为:0.225 mol/L?min;
②A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点),浓度相等而不是不变,故不选;
B.容器内气体的压强不随时间的变化而变化,说明正逆反应速率相等,说明已达平衡状态,故选;
C.单位时间内每消耗3mol H2,同时生成1mol H2O,从反应开始到平衡始终相等,故不一定平衡,故不选;
D.CO2的体积分数在混合气体中保持不变,说明正逆反应速率相等,达平衡状态,故选;
故答案为:BD;
③使n(CH3OH)/n(CO2)增大,应采取措施,使平衡向正反应移动,但不能只增大二氧化碳或降低甲醇的量,
A.将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故A正确;
B.恒温恒容充入He,使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.恒温恒压充入He,体积增大,相当于减小压强,平衡逆向移动比值减小,故C错误;
D.再充入1mol CO2和3mol H2,等效为增大压强,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故D正确;
故答案为:AD;
(2)①任一组数据温度升高二氧化碳的转化率再减小,正反应为放热反应,温度越高K值越小,故答案为:越小;
②提高氢碳比[n(H2)/n(CO2)],温度未变,K值不变,故答案为:不变;
(3)Qc=
=0.8<1.64=K,所以平衡正向移动,故答案为:正;
(4)当反应达到平衡后,在其他条件不变时,若升高温度,正逆反应速率都变大,正反应变化的幅度更大,故答案为: .
.
| 0.75mol/L |
| 10min |
②A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点),浓度相等而不是不变,故不选;
B.容器内气体的压强不随时间的变化而变化,说明正逆反应速率相等,说明已达平衡状态,故选;
C.单位时间内每消耗3mol H2,同时生成1mol H2O,从反应开始到平衡始终相等,故不一定平衡,故不选;
D.CO2的体积分数在混合气体中保持不变,说明正逆反应速率相等,达平衡状态,故选;
故答案为:BD;
③使n(CH3OH)/n(CO2)增大,应采取措施,使平衡向正反应移动,但不能只增大二氧化碳或降低甲醇的量,
A.将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故A正确;
B.恒温恒容充入He,使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.恒温恒压充入He,体积增大,相当于减小压强,平衡逆向移动比值减小,故C错误;
D.再充入1mol CO2和3mol H2,等效为增大压强,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故D正确;
故答案为:AD;
(2)①任一组数据温度升高二氧化碳的转化率再减小,正反应为放热反应,温度越高K值越小,故答案为:越小;
②提高氢碳比[n(H2)/n(CO2)],温度未变,K值不变,故答案为:不变;
(3)Qc=
| 0.22 |
| 0.05 |
(4)当反应达到平衡后,在其他条件不变时,若升高温度,正逆反应速率都变大,正反应变化的幅度更大,故答案为:
 .
.点评:本题考查化学平衡的有关计算,本题难度不大,做题时注意平衡常数的计算和应用.

练习册系列答案
相关题目

 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径. CO+3H2
CO+3H2