题目内容
18.反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少0.6mol•L-1.对此反应速率的表示,正确的是( )| A. | 用A表示的反应速率是0.4mol•(L•min)-1 | |
| B. | 在2min末的反应速率,用B表示是0.3mol•(L•min)-1 | |
| C. | 分别用B、C、D表示反应的速率,其比是3:2:1 | |
| D. | 在这2min内用B和C表示的反应速率的值都是逐渐减小的 |
分析 经2min,B的浓度减少0.6mol/L,v(B)=$\frac{0.6mol/L}{2min}$=0.3mol•(L•min)-1,结合反应速率之比等于化学计量数之比来解答.
解答 解:经2min,B的浓度减少0.6mol/L,v(B)=$\frac{0.6mol/L}{2min}$=0.3mol•(L•min)-1,
A.A物质为纯固体,不能表示反应速率,故A错误;
B.反应速率为平均速率,则在2min内的反应速率,用B表示是0.3 mol•(L•min)-1,故B错误;
C.反应速率之比等于化学计量数之比,则分别用B、C、D表示的反应速率其比值是3:2:1,故C正确;
D.B为反应物,C为生成物,则在这2min内用B和C表示的反应速率的值都是逐渐减小,故D正确;
故选CD.
点评 本题考查化学反应速率的计算及与化学计量数的关系,明确计算公式及反应速率为平均速率即可解答,注意选项A为易错点,题目难度不大.

练习册系列答案
相关题目
9.在检验溶液中SO42-的过程中,下列操作中正确的是( )
| A. | 先加入稀硝酸,无沉淀产生,然后再加硝酸钡溶液,产生白色沉淀,证明有SO42-存在 | |
| B. | 先加入硝酸钡溶液,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在 | |
| C. | 先加入稀盐酸,无产生沉淀,然后再加氯化钡溶液,产生白色沉淀,证明有SO42-存在 | |
| D. | 先加入氯化钡溶液,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在 |
6.已知在溶液中IO3-与I-发生反应5I-+IO3-+6H+═3I2↓+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行实验,证明食盐中存在IO3-.可供选用的物质有:
①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤蔗糖,⑥食醋,⑦白酒.进行上述实验时必须使用的物质是( )
①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤蔗糖,⑥食醋,⑦白酒.进行上述实验时必须使用的物质是( )
| A. | ①③ | B. | ③⑥ | C. | ②④⑥ | D. | ①②④⑤⑦ |
13.化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面的说法错误的是( )
| A. | 能够提高化学反应速率 | B. | 能够提高产品的产量 | ||
| C. | 能够提高经济效益 | D. | 能够节约原料和能源 |
3.化学与科学、技术、社会、环境密切相关.下列说法不正确的是( )
| A. | 锂可用于制造质量轻、电容量大的可充电电池 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 太阳能电池板中有高纯硅单质,光导纤维的主要成分是二氧化硅 |
7.如表是元素周期表的一部分,按要求完成各小题.
(1)元素①的元素符号:Na
(2)元素⑧的单质电子式
(3)元素⑤的原子结构示意图
(4)①③⑤⑧⑩中,化学性质最不活泼的元素Ar(填元素,下同),非金属性最强的元素是Cl,金属性最强的单质Na.
(5)①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH.①②③三种元素的原子半径最大的是K.
(6)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高价氧化物的水化物和盐酸反应的化学方程式为Al(OH)3+3HCl=AlCl3+3H2O,单质与氢氧化钠溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)元素⑧的单质电子式

(3)元素⑤的原子结构示意图

(4)①③⑤⑧⑩中,化学性质最不活泼的元素Ar(填元素,下同),非金属性最强的元素是Cl,金属性最强的单质Na.
(5)①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH.①②③三种元素的原子半径最大的是K.
(6)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高价氧化物的水化物和盐酸反应的化学方程式为Al(OH)3+3HCl=AlCl3+3H2O,单质与氢氧化钠溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
8.下列过程中,不属于氮的固定的是( )
| A. | 闪电时,N2变为NO | B. | NO被空气中O2氧化为NO2 | ||
| C. | 工业上,N2和H2反应生成NH3 | D. | 豆科植物根瘤菌把N2变成NH3 |
 .
.
 ,由两种元素组成的三原子共价化合物的电子式
,由两种元素组成的三原子共价化合物的电子式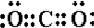 或
或 .(各写1种)
.(各写1种)