题目内容
13.今有A、B、C、D四种元素,其中A元素是1826年法国青年科学家巴拉尔发现的.他在研究海水制盐时,往剩余的副产物苦卤中通入氯气后发现溶液颜色变深,若经进一步提取,可得一种红棕色液体,有刺鼻的臭味.B、C、D的原子电子层排布均不超过3个电子层.D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外电子层上的电子数恰好相等.D原子的最内电子层上电子数是B原子核外电子数的2倍.则:(1)四种元素分别是为:(写元素符号)ABr,BH,CO,DS.
(2)写出巴拉尔发现A元素单质的离子方程式:Cl2+2Br-═2Cl-+Br2.
(3)写出由上述某元素的单质与另外两种元素的化合物反应生成两种酸的化学方程式Br2+H2O=HBr+HBrO.
分析 A、B、C、D四种元素,A元素是一种红棕色液体,有刺鼻的臭味,则A单质是溴,则A元素是Br元素;B、C、D的原子电子层排布均不超过3个电子层,D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外电子层上的电子数恰好相等,说明C、D是同一主族元素,则C是O元素、D是S元素;D原子的最内电子层上电子数是B原子核外电子数的2倍,则B是H元素,即A是Br元素、B是H元素、C是O元素、D是S元素,再结合物质性质解答.
解答 解:A、B、C、D四种元素,A元素是一种红棕色液体,有刺鼻的臭味,则A单质是溴,则A元素是Br元素;B、C、D的原子电子层排布均不超过3个电子层,D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外电子层上的电子数恰好相等,说明C、D是同一主族元素,则C是O元素、D是S元素;D原子的最内电子层上电子数是B原子核外电子数的2倍,则B是H元素,即A是Br元素、B是H元素、C是O元素、D是S元素,
(1)通过以上分析知,A是Br元素、B是H元素、C是O元素、D是S元素,
故答案为:Br;H;O;S;
(2)海水提溴的原理是利用Cl2将Br-氧化成Br2,离子方程式为:Cl2+2Br-═2Cl-+Br2,
故答案为:Cl2+2Br-═2Cl-+Br2;
(3)类比Cl2和水反应Cl2+H2O=HCl+HClO,所以Br2可以和H2O反应生成HBr和HBrO两种酸,反应方程式为Br2+H2O=HBr+HBrO,
故答案为:Br2+H2O=HBr+HBrO.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,推断元素为解答结构,注意熟练掌握原子结构与元素周期表、元素周期律的关系,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
相关题目
3.下列物质中,含有Cl-的是( )
①盐酸 ②氯化钠溶液 ③氯化钠固体 ④次氯酸 ⑤氯化氢气体⑥氯仿.
①盐酸 ②氯化钠溶液 ③氯化钠固体 ④次氯酸 ⑤氯化氢气体⑥氯仿.
| A. | ①②⑥ | B. | ①②③ | C. | ③④⑥ | D. | ②④⑤ |
4.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+.下列有关说法正确的是( )
| A. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| B. | 检测时,电解质溶液中的 H+向负极移动 | |
| C. | 若有 0.4 mol 电子转移,则在标准状况下消耗 4.48 L 氧气 | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
8.化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2-甲基丁烷.若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
| A. | CH3CH2CH2CH2CH2OH | B. | 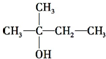 | ||
| C. | 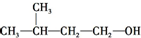 | D. | 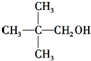 |
18.下列颜色变化与氧化还原反应无关的是( )
| A. | 将乙醛加入新制氢氧化铜中加热,出现砖红色沉淀 | |
| B. | 将乙醇滴入酸性重铬酸钾溶液中,溶液由橙色变为绿色 | |
| C. | 将二氧化硫通入滴有酚酞的氢氧化钠溶液中,溶液红色褪去 | |
| D. | 新制氯水敞口久置,颜色褪去 |
5.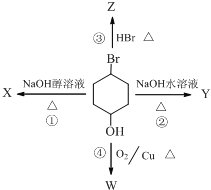 如图表示4-溴-1-环己醇所发生的4个不同反应,若生成物只含有一种官能团,则全部符合条件的反应有( )
如图表示4-溴-1-环己醇所发生的4个不同反应,若生成物只含有一种官能团,则全部符合条件的反应有( )
 如图表示4-溴-1-环己醇所发生的4个不同反应,若生成物只含有一种官能团,则全部符合条件的反应有( )
如图表示4-溴-1-环己醇所发生的4个不同反应,若生成物只含有一种官能团,则全部符合条件的反应有( )| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ①②③④ |
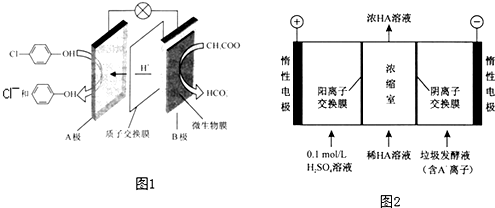
 )的废水可以通过构成微生物电池除去,其原理如图1所示.
)的废水可以通过构成微生物电池除去,其原理如图1所示. -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.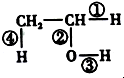 (1)在烷烃分子中,每增加一个碳原子,1mol 烷烃完全燃烧需要多消耗氧气(填字母)B.
(1)在烷烃分子中,每增加一个碳原子,1mol 烷烃完全燃烧需要多消耗氧气(填字母)B.