题目内容
(1)N2与O2反应生成1gNO (g),需吸收QkJ的热量,写出其热化学方程式:
(2)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列的3个热化学反应方程式:
Fe203(s)+3CO(g)=2Fe(s)+3C02(g)△H=-Q1kJ/mol
Fe203(s)+
CO(g)=
Fe3O4(s)+
C02(g)△H=-Q2kJ/mol
Fe304(s)+CO(g)=3FeO(s)+C02(g)△H=+Q3kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
N2(g)+O2(g)=2NO(g)△H=-60QKJ/mol
N2(g)+O2(g)=2NO(g)△H=-60QKJ/mol
(2)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列的3个热化学反应方程式:
Fe203(s)+3CO(g)=2Fe(s)+3C02(g)△H=-Q1kJ/mol
Fe203(s)+
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
Fe304(s)+CO(g)=3FeO(s)+C02(g)△H=+Q3kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-(3Q1+2Q3-3Q2)/6KJ/mol
CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-(3Q1+2Q3-3Q2)/6KJ/mol
.分析:(1)依据热化学方程式的书写方法写出,标明物质聚集状态和对应量下的反应焓变;
(2)依据盖斯定律内容,结合热化学方程式计算得到;
(2)依据盖斯定律内容,结合热化学方程式计算得到;
解答:解:(1)N2与O2反应生成1gNO (g),需吸收QkJ的热量,反应中 生成一氧化氮为60g,反应放热为60QKJ;反应的热化学方程式为:N2(g)+O2(g)=2NO(g)△H=-60QKJ/mol;故答案为;N2(g)+O2(g)=2NO(g)△H=-60QKJ/mol;
(2)(1)N2与O2反应生成1gNO (g),需吸收QkJ的热量,写出其热化学方程式:N2(g)+O2(g)=2NO(g)△H=-60QKJ/mol
依据盖斯定律分析,依据热化学方程式计算得到
①Fe203(s)+3CO(g)=2Fe(s)+3C02(g)△H=-Q1kJ/mol
②Fe203(s)+
CO(g)=
Fe3O4(s)+
C02(g)△H=-Q2kJ/mol
③Fe304(s)+CO(g)=3FeO(s)+C02(g)△H=+Q3kJ/mol
依据盖斯定律①×3-②×3+③×2得到:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-(3Q1+2Q3-3Q2)/6KJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-(3Q1+2Q3-3Q2)/6KJ/mol;
(2)(1)N2与O2反应生成1gNO (g),需吸收QkJ的热量,写出其热化学方程式:N2(g)+O2(g)=2NO(g)△H=-60QKJ/mol
依据盖斯定律分析,依据热化学方程式计算得到
①Fe203(s)+3CO(g)=2Fe(s)+3C02(g)△H=-Q1kJ/mol
②Fe203(s)+
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
③Fe304(s)+CO(g)=3FeO(s)+C02(g)△H=+Q3kJ/mol
依据盖斯定律①×3-②×3+③×2得到:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-(3Q1+2Q3-3Q2)/6KJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-(3Q1+2Q3-3Q2)/6KJ/mol;
点评:本题考查了热化学方程式的书写和注意问题,盖斯定律的计算应用,题目难度中等.

练习册系列答案
相关题目
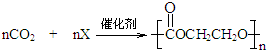 ,则X的结构简式为
,则X的结构简式为
 CO(g)=
CO(g)= Fe3O4(s)+
Fe3O4(s)+ C02(g)△H=-Q2kJ/mol
C02(g)△H=-Q2kJ/mol