题目内容
7.锶有“金属味精”之称.以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如图: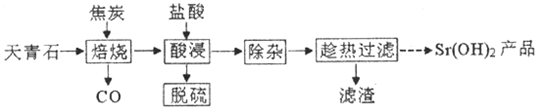
已知氢氧化锶在水中的溶解度:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
| 溶液度(g/100ml) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(2)“除杂”方法:将溶液升温至95℃,加NaoH溶液调节pH为12.
①95℃时水的离子积Kw=1.0×10-12,Ksp[mg (OH)2]=1.2×10-10则溶液中c(Mg2+)=1.2×10-10mol•L-1
②若PH过大,将导致氢氧化锶的产率降低,请解释原因OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,将使氢氧化锶沉淀析出
(3)‘趁热过滤”的目的是防止温度降低使氢氧化锶析出而造成损失,“滤渣”的主要成分为Ca(OH)2、Mg(OH)2
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶、过滤、洗涤、干燥.
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时发生反应的化学方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl.
分析 以天青石(主要含有SrSO4和少量CaCO3,MgO杂质)为原料制备Sr(OH)2,由流程可知,天青石和碳隔绝空气高温焙烧生成CO、SrS,CaCO3生成CaO,加盐酸溶解MgO、SrS、CaO,其中SrS与盐酸反应生的硫化氢气体,得到的溶液Mg2+、Ca2+、Sr2+,将溶液升温至95℃,加NaOH溶液调节pH为12,沉淀Mg2+、Ca2+,趁热过滤,滤渣为Mg(OH)2、Mg(OH)2,将滤液冷却结晶得到Sr(OH)2,以此解答该题.
解答 解:(1)隔绝空气焙烧时SrSO4只被还原成SrS,碳过量,则碳被氧化生成CO,反应为:SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑;
故答案为:SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑;
(2)①95℃时水的离子积KW=1.0×10-12,pH=12,故c(OH-)=1mol/L,Ksp[Mg(OH)2]=1.2×10-10,
则溶液中c(Mg2+)=$\frac{1.2×1{0}^{-10}}{{1}^{2}}$mol•L-1=1.2×10-10mol•L-1,
故答案为:1.2×10-10mol•L-1;
②若pH过大,OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,导致氢氧化锶沉淀析出,将导致氢氧化锶的产率降低;
故答案为:OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,将使氢氧化锶沉淀析出;
(3)根据表可知氢氧化锶的溶解度随温度的升高而增大,氢氧化钙的溶解度随温度的升高而降低,趁热过滤可以防止温度降低氢氧化锶析出造成产品的损失,可使钙离子尽可能转化为Ca(OH)2,调节pH沉淀了镁离子,故滤渣为Mg(OH)2、Mg(OH)2;
故答案为:防止温度降低使氢氧化锶析出而造成损失;Ca(OH)2、Mg(OH)2;
(4)趁热过滤后的滤液中得到Sr(OH)2产品,Sr(OH)2温度较低时析出,故步骤为降温结晶或冷却结晶过滤、洗涤、干燥;
故答案为:降温结晶;
(5)氯化铁与硫化氢发生氧化还原反应生成氯化亚铁、硫和盐酸,方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl,
故答案为:2FeCl3+H2S=2FeCl2+S↓+2HCl.
点评 本题考查了物质的制备,为高考常见题型,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、溶度积的计算等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案| A. | 质子数 | B. | 电子数 | C. | 分子总数 | D. | 质量 |
①钠浮在水面上;
②钠沉在水底;
③钠熔化成小球;
④小球迅速游动逐渐减小,最后消失;
⑤发出嘶嘶的声音;
⑥滴入酚酞后溶液显红色.
其中正确的一组是( )
| A. | ②③④⑤⑥ | B. | 全部 | C. | ①③④⑤⑥ | D. | ①③④⑥ |
| A. | 乙烯使溴的四氯化碳褪色 | B. | 二氧化碳使 Na2O2固体变白 | ||
| C. | 氯气使碘化钾溶液变黄 | D. | SO2使酸性高锰酸钾溶液褪色 |
| A. | 增大反应物浓度可以增大单位体积内活化分子数,但活化分子百分数不变,从而使反应速率增大 | |
| B. | 在化学反应中,能量较高、能发生碰撞的分子称为活化分子 | |
| C. | 汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可降低NO和CO反应的活化能 | |
| D. | 溶液中的离子反应瞬间发生,其反应的活化能接近为零 |
| A. | 硫酸铝溶液中加入过量氨水 Al3++3OH-=Al(OH)3↓ | |
| B. | 电解饱和食盐水 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2OH- | |
| C. | 碳酸钙与盐酸反应 CO32-+2H+=CO2↑+H2O | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2=Fe3++2H2O |
| A. | 相同温度下,pH=10的KOH溶液和pH=10的K2CO3溶液由水电离出的OH-浓度 | |
| B. | 0.1 mol•L-1(NH4)2SO4溶液与0.1 mol•L-1(NH4)2CO3溶液中NH4+浓度 | |
| C. | Na2CO3溶液中HCO3-和OH-的浓度 | |
| D. | 纯水在80℃和在常温下的pH |

下列叙述错误的是( )
| A. | X、Y和Z均能使溴水褪色 | |
| B. | X和Z均能与NaHCO3溶液反应放出CO2 | |
| C. | Y既能发生取代反应,也能发生加成反应 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |
 某气态不饱和链烃CxHy在一定条件下与H2加成为CxHy+m,取CxHy和H2混合气体共120mL进行实验,发现随混合气体中H2所占体积的变化,反应后得到的气体总体积数也不同,反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温间压下测定)由此可知m的数值为( )
某气态不饱和链烃CxHy在一定条件下与H2加成为CxHy+m,取CxHy和H2混合气体共120mL进行实验,发现随混合气体中H2所占体积的变化,反应后得到的气体总体积数也不同,反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温间压下测定)由此可知m的数值为( )