题目内容
实验室用浓盐酸和二氧化锰共热制取氯气,现要制取一瓶干燥纯净的氯气,并防止剩余氯气逸出污染空气.现有下列仪器和药品可使用:

(1)在装置中,饱和食盐水的作用是 .
(2)气体尾气吸收装置中进行的反应方程式为
(3)用湿润的淀粉碘化钾试纸伸到集气瓶口可检验氯气是否收集满,反应的离子方程式是 .

(1)在装置中,饱和食盐水的作用是
(2)气体尾气吸收装置中进行的反应方程式为
(3)用湿润的淀粉碘化钾试纸伸到集气瓶口可检验氯气是否收集满,反应的离子方程式是
考点:氯气的实验室制法
专题:
分析:(1)实验室用浓盐酸和二氧化锰在加热条件下反应生成氯气,由于氯气难溶于饱和食盐水,可用饱和食盐水除去氯化氢气体;
(2)氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置吸收氯气,反应生成氯化钠和次氯酸钠和水;
(3)用湿润的淀粉碘化钾试纸伸到集气瓶口可检验氯气是否收集满,反应的离子方程式为2I-+Cl2=I2+2Cl-.
(2)氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置吸收氯气,反应生成氯化钠和次氯酸钠和水;
(3)用湿润的淀粉碘化钾试纸伸到集气瓶口可检验氯气是否收集满,反应的离子方程式为2I-+Cl2=I2+2Cl-.
解答:
解:实验室用第一个装置制备氯气,气体分别通入盛有饱和氯化钠溶液的洗气瓶和盛有浓硫酸的洗气瓶,除杂干燥后用向上排空法收集氯气,氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置收集.
(1)实验室可以采用加热二氧化锰固体和浓盐酸的方法制取氯气,反应的化学方程式为:MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑,加热二氧化锰固体和浓盐酸的方法制取氯气时,产生的氯气中容易混有氯化氢气体,要除去氯化氢气体,所选的除杂试剂只能吸收氯化氢而不能吸收氯气,故可以使用饱和食盐水将其除去,
故答案为:除去氯气中HCl杂质气体;
(2)氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置收集,氯气与NaOH反应生成氯化钠和次氯酸钠,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(3)氯气具有强氧化性,能与I-反应生成I2,湿润的淀粉碘化钾试纸变蓝,反应的离子方程式为2I-+Cl2=I2+2Cl-,故答案为:2I-+Cl2=I2+2Cl-.
(1)实验室可以采用加热二氧化锰固体和浓盐酸的方法制取氯气,反应的化学方程式为:MnO2+4HCl(浓)
| ||
故答案为:除去氯气中HCl杂质气体;
(2)氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置收集,氯气与NaOH反应生成氯化钠和次氯酸钠,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(3)氯气具有强氧化性,能与I-反应生成I2,湿润的淀粉碘化钾试纸变蓝,反应的离子方程式为2I-+Cl2=I2+2Cl-,故答案为:2I-+Cl2=I2+2Cl-.
点评:本题考查了制取氯气实验相关内容,注意实验室制备气体的实验装置和反应原理,把握物质的主要性质,注重基础知识的积累,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、含有肽键的有机化合物遇到双缩脲试剂会产生紫玫瑰色,葡萄糖与新制氢氧化铜悬浊液混合出现绛蓝色 |
B、2,3-二甲基戊醛的键线式为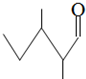 |
C、化合物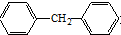 是苯的同系物 是苯的同系物 |
D、S-诱抗素的结构简式为: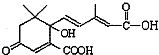 则l mol S-诱抗素与氢氧化钠溶液反应时,最多消耗3 mol NaOH 则l mol S-诱抗素与氢氧化钠溶液反应时,最多消耗3 mol NaOH |
下列离子方程式改写成化学方程式正确的是( )
| A、Cu2++2OH-=Cu(OH)2↓ CuCO3+2NaOH=Cu(OH)2↓+Na2CO3 |
| B、CO32-+2H+=CO2+H2O BaCO3+2HCl=BaCl2+CO2+H2O |
| C、Ca2++CO32-=CaCO3↓ Ca(NO3)2+Na2CO3=CaCO3↓+NaNO3 |
| D、H++OH-=H2O 2KOH+H2SO4=K2SO4+2H2O |
某无色透明的溶液中加入铝粉能放出氢气,此溶液中一定能大量共存的离子组是( )
| A、H+、Cu2+、Cl-、SO42- |
| B、HCO3-、NO3-、SO42-、Na+ |
| C、Cl-、SO42-、K+、Na+ |
| D、Ca2+、SO42-、CO32-、Cl- |
节能减排指的是减少能源浪费和降低废气排放,下列措施不符合节能减排的是( )
| A、工业制硫酸时,设置“废热”锅炉产生蒸气,用于发电 |
| B、开采更多的能源,提高能源开采量 |
| C、燃烧煤的锅炉采用类似沸腾炉的锅炉 |
| D、推广使用乙醇汽油从而减轻大气污染,改善大气环境 |