题目内容
用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、同温同压下,体积相同的氢气和氩气所含的原子数相等 |
| B、常温常压下,22.4 L 的C2H2气体和C2H4气体的混合物中含有的碳原子数目为0.2NA |
| C、2.4g金属镁与足量的盐酸反应,生成氢分子数目为2NA |
| D、1mol NH4+中含有电子数为10NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.稀有气体为单原子分子,氢气与氩气的物质的量相等,二者含有的原子数一定不相同;
B.常温常压下,不是标准状况下,不能使用标况下的气体摩尔体积计算混合气体的物质的量;
C.镁为2价金属,2.4g镁的物质的量为0.1mol,0.1mol镁与盐酸完全反应生成0.1mol氢气;
D.铵根离子中含有10mol,1mol铵根离子中含有10mol电子.
B.常温常压下,不是标准状况下,不能使用标况下的气体摩尔体积计算混合气体的物质的量;
C.镁为2价金属,2.4g镁的物质的量为0.1mol,0.1mol镁与盐酸完全反应生成0.1mol氢气;
D.铵根离子中含有10mol,1mol铵根离子中含有10mol电子.
解答:
解:A.同温同压下,体积相同的氢气和氩气所含分子的物质的量相等,氢气为双原子分子,而氩气为单原子分子,所以等物质的量的氢气和氩气含有的原子数不相等,故A错误;
B.不是标准状况下,不能使用标况下的气体摩尔体积金属22.4L混合气体的物质的量,故B错误;
C.2.4g镁的物质的量为0.1mol,0.1mol镁与足量盐酸反应生成0.1mol氢气,生成氢分子数目为0.1NA,故C错误;
D.1mol铵根离子中含有10mol电子,含有电子数为10NA,故D正确;
故选D.
B.不是标准状况下,不能使用标况下的气体摩尔体积金属22.4L混合气体的物质的量,故B错误;
C.2.4g镁的物质的量为0.1mol,0.1mol镁与足量盐酸反应生成0.1mol氢气,生成氢分子数目为0.1NA,故C错误;
D.1mol铵根离子中含有10mol电子,含有电子数为10NA,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的计算及判断,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的转化关系,明确标况下气体摩尔体积的使用条件,选项A为易错点,注意稀有气体为单原子分子.

练习册系列答案
相关题目
下列各组离子中,能在酸性溶液中大量共存的是( )
| A、K+、Mg2+、Cl-、NO3- |
| B、Ba2+、Ca2+、Cl-、CO32- |
| C、Na+、OH-、Mg2+、Cl- |
| D、Mg2+、Cu2+、CO32-、SO42- |
对于反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O,以下叙述正确的是( )
| A、Cl2是氧化剂,NaOH是还原剂 |
| B、被氧化的Cl原子和被还原的Cl原子的物质的量之比为1:5 |
| C、NaClO3既是氧化产物,又是还原产物 |
| D、每生成1mol的NaClO3,转移6mol的电子 |
分析:在4Fe3++2H2O=4Fe2++4H++O2↑反应中,每生成标准状况下22.4LO2,电子转移的个数为( )
| A、6.02×1023 |
| B、1.806×1024 |
| C、1.204×1024 |
| D、2.408×1024 |
下列关于强、弱电解质的叙述,有错误的是( )
| A、强电解质在溶液中完全电离,不存在电离平衡 |
| B、在溶液中,导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
| C、强电解质都是离子化合物,弱电解质都是共价化合物 |
| D、纯净的强电解质在液态时,有的导电,有的不导电 |
下列对于与生产、生活有关的化学问题的分析正确的是( )
| A、对“地沟油”进行分馏可得到汽油 |
| B、向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量 |
| C、误食可溶性重金属盐后,应采取的有效应急措施是喝大量的豆浆或牛奶 |
| D、PM2.5二氧化碳都属于空气质量日报的内容 |
下列有关物质结构和性质的说法中,正确的是( )
| A、元素非金属性Cl>S的实验依据是酸性HCl>H2S | ||
| B、二氧化碳分子中存在共价键和分子间作用力 | ||
C、SO
| ||
D、ClO
|
从柑桔中炼制萜二烯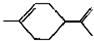 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )
 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A、分子式为C10H16 |
| B、常温下为液态,难溶于水 |
C、与过量的溴的CCl4溶液反应后产物为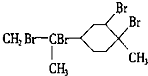 |
| D、它不能使酸性高锰酸钾溶液褪色 |