题目内容
某温度下CaF2饱和溶液的物质的量浓度为2×10-4mol/L,则在此温度下CaF2的溶解度为( )
(设CaF2在水中达到饱和时,溶液密度=1g/cm3)
(设CaF2在水中达到饱和时,溶液密度=1g/cm3)
| A、1.56×10-3g |
| B、1.56×10-2g |
| C、7.8×10-4g |
| D、无法计算 |
考点:溶解度、饱和溶液的概念
专题:物质的量浓度和溶解度专题
分析:根据c=
计算该饱和溶液的质量分数,再根据饱和溶液的质量分数ω=
计算溶解度.
| 1000ρω |
| M |
| s |
| 100+s |
解答:
解:由于溶质摩尔质量为c=78 g/mol,饱和溶液密度为ρ=1 g/cm3,c=2×10-4mol/L,带入公式:c=
得:2×10-4=
,解得:ω=1.56×10-5;
设在此温度下CaF2的溶解度为S g,
则该饱和溶液的质量分数ω=
=1.56×10-5,解得:s=1.56×10-3,故选A.
| 1000ρω |
| M |
| 1000×1×ω |
| 78 |
设在此温度下CaF2的溶解度为S g,
则该饱和溶液的质量分数ω=
| s |
| 100+s |
点评:本题考查物质的量浓度与溶解度关系,难度中等,关键是对物质的量浓度的理解,可以根据定义计算.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目
等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,混和液中有关离子的浓度应满足的关系是( )
| A、c(M+)>c( OH-)>c(A-)>c(H+) |
| B、c(M+)>c(A-)>c(H+)>c( OH-) |
| C、c(M+)>c(A-)>c( OH-)>c(H+) |
| D、c(M+)>c(H+)=c( OH-)+c(A-) |
下列化学反应的离子方程式正确的是( )
| A、用醋酸除去水垢:2CH3COOH+CO32-═2CH3COO-+H2O+CO2↑ |
| B、稀硝酸中加入过量的铁屑:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |
| C、铝与氢氧化钠溶液反应:A1+2OH-═A1O2-+H2-↑ |
| D、等物质的量的KHSO4和Ba(OH)2的溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
在溶液中可以共存,加强碱(OH-)产生沉淀,加强酸(H+)生成气体的离子组是( )
| A、Na+、Cu2+、CO32-、Cl- |
| B、HCO3-、Cl-、Na+、Mg2+ |
| C、Cl-、NO3-、K+、Ca2+ |
| D、SO42-、H+、K+、NH4+ |
下列各组离子中,一定能大量共存的是( )
| A、由水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Br-、BrO3-、NO3- |
| B、加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl- |
| C、含有大量Br2分子的溶液中:Ca2+、Fe3+、Cl-、NO3- |
| D、含有大量Fe2+的溶液中:K+、Mg2+、NO3-、ClO- |
下列结构式表示一种有机物的结构: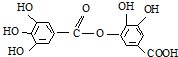 关于它的性质叙述中,正确的是( )
关于它的性质叙述中,正确的是( )
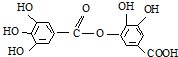 关于它的性质叙述中,正确的是( )
关于它的性质叙述中,正确的是( )| A、它有弱酸性,能与KOH反应 |
| B、可以水解生成一种生成物 |
| C、不能与强碱溶液反应 |
| D、可以水解生成两种生成物 |
下列叙述中错误的是( )
| A、水玻璃和石英的主要成份都是SiO2 |
| B、Al和Cu都是用还原法从它们的矿石中冶炼出来 |
| C、氧化铝陶瓷和氮化硅陶瓷都属于高温结构陶瓷 |
| D、常温下浓硫酸和浓硝酸都可贮存在铁制容器中 |