题目内容
20.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HCl |
分析 溶液中存在平衡Cl2+H2O?HCl+HClO,只有氯气有颜色,为黄绿色,氯水中含有氯气而呈浅黄绿色,溶液中HCl与硝酸银反应产生AgCl白色沉淀,而溶液呈酸性,能与碳酸氢钠反应生成二氧化碳,溶液中氯气、HClO都强氧化性,都可以将亚铁离子氧化为铁离子,而使溶液变为棕黄色.
解答 解:溶液中存在平衡Cl2+H2O?HCl+HClO,
A.只有氯气有颜色,为黄绿色,氯水呈浅黄绿色是由于含有氯气,故A正确;
B.溶液与硝酸银反应产生白色沉淀,只能是氯离子与银离子反应得到AgCl白色沉淀,说明氯水中含有Cl-,故B正确;
C.向氯水中加入NaHCO3粉末,有气泡产生,说明溶液呈酸性即氯水中含有H+,故C正确;
D.溶液中氯气、HClO都强氧化性,都可以将亚铁离子氧化为铁离子,而使溶液变为棕黄色,不能说明氯水中含有HCl,故D错误,
故选D.
点评 本题考查氯水的性质,难度不大,侧重对基础知识的考查,需要学生熟练掌握基础知识.

练习册系列答案
相关题目
15.有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:
①CH3COONa与HCl; ②CH3COONa与NaOH; ③CH3COONa与NaCl;
④CH3COONa与NaHCO3,下列各项排序正确的是( )
①CH3COONa与HCl; ②CH3COONa与NaOH; ③CH3COONa与NaCl;
④CH3COONa与NaHCO3,下列各项排序正确的是( )
| A. | pH:②>③>④>① | B. | c(CH3COO-):②>④>③>① | ||
| C. | 溶液中c(Na+):①>③>②>④ | D. | c(CH3COOH):①>④>③>② |
16.下列叙述中,正确的是( )
| A. | 二氧化硫溶于水能导电,故二氧化硫是电解质 | |
| B. | 强电解质溶液的导电性一定强于弱电解质溶液的导电性 | |
| C. | 元素从化合态变为游离态,该元素一定被还原 | |
| D. | 发生氧化反应的物质也可能同时发生还原反应 |
8.NaCl是一种化工原料,可以制备一系列物质(见图).下列说法正确的是( )
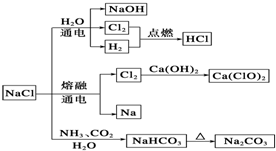

| A. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应 | |
| B. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| C. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| D. | 图中所示转化反应都是氧化还原反应 |
5.分离下列混合物,按溶解、过滤、蒸发的操作顺序进行的是( )
| A. | 硝酸钠、氢氧化钠 | B. | 氧化铜、二氧化锰 | C. | 二氧化锰、氯化钾 | D. | 硫酸铜、氢氧化钙 |
12.分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法.如表(2)中的物质不能与(1)中的物质归为一类的是( )
| 选项 | (1) | (2) |
| A | FeSO4、NO2、MnO2、NaClO、Na2O2 | H2SO3 |
| B | CH3COOH、HOOC-COOH、HClO、H2S | HF |
| C | 复分解反应、电极反应、放热反应、离子反应 | 焰色反应 |
| D | (NH4)2SO4、NH4Cl、NH4NO3、NH3•H2O | NH4HCO3 |
| A. | A | B. | B | C. | C | D. | D |