题目内容
已知有A、B、C、D、E五种短周期元素元素,其原子序数依次增大.F是常见的金属,在潮湿的空气中被腐蚀形成红棕色固体.A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正价与最低负价的代数和为6,D是同周期中离子半径最小的元素.
(1)五种元素中,金属性最强的元素在周期表的位置是 写出D元素的原子结构示意图
(2)B元素的气态氢化物与其最高价氧化物对应的水化物化合,生成物的水溶液呈 性,原因 (离子方程式表示)上述化合物浓溶液滴加到Mg(OH)2悬浊液中,沉淀逐渐消失最后澄清,请解释澄清的原因
(3)含F的二价离子的酸性溶液,在空气中易被氧化变质,该过程的离子反应为: 检验该二价离子没有被完全氧化的方法为:
(4)E元素的最高价氧化物对应的水化物与D元素的最高价氧化物对应的水化物反应的化学方程式为 .
(1)五种元素中,金属性最强的元素在周期表的位置是
(2)B元素的气态氢化物与其最高价氧化物对应的水化物化合,生成物的水溶液呈
(3)含F的二价离子的酸性溶液,在空气中易被氧化变质,该过程的离子反应为:
(4)E元素的最高价氧化物对应的水化物与D元素的最高价氧化物对应的水化物反应的化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:F是常见的金属,在潮湿的空气中被腐蚀形成红棕色固体,则F为Fe元素;E元素的最高正化合价与最低化合价的代数和为6,则E最外层含有7个电子,为ⅤⅡA族元素;A与E形成共价化合物,由于E为非金属,则A为非金属元素,且A与B形成化合物的水溶液呈碱性,则该化合物为氨气,原子序数A<B,则为H元素、N元素;A、C同主族,C的原子序数大于N元素,则C为Na元素;D是同周期中离子半径最小的元素,则D一定为金属元素,其位于第三周期,且为第三周期中原子序数最大的金属元素,则D为Al元素;E为原子序数大于Na元素,最外层7个电子,则E为Cl元素,据此进行解答.
解答:
解:F是常见的金属,在潮湿的空气中被腐蚀形成红棕色固体,则F为Fe元素;E元素的最高正化合价与最低化合价的代数和为6,则E最外层含有7个电子,为ⅤⅡA族元素;A与E形成共价化合物,由于E为非金属,则A为非金属元素,且A与B形成化合物的水溶液呈碱性,则该化合物为氨气,原子序数A<B,则为H元素、N元素;A、C同主族,C的原子序数大于N元素,则C为Na元素;D是同周期中离子半径最小的元素,则D一定为金属元素,其位于第三周期,且为第三周期中原子序数最大的金属元素,则D为Al元素;E为原子序数大于Na元素,最外层7个电子,则E为Cl元素,
(1)根据分析可知,五中元素中,金属性最强的元素为Na元素,Na的原子序数为11,在周期表中位于第三周期 IA族;D为Al元素,其原子结构示意图为:,
故答案为:第三周期 IA族; ;
;
(2)B为N元素,N的气态氢化物为氨气,其最高价氧化物对应的水化物为硝酸,氨气与硝酸反应生成硝酸铵,由于铵根离子部分水解,溶液显示酸性,铵根离子水解的离子方程式为:NH4++H2O?NH3?H2O+H+;氢氧化镁浊液中存在溶解平衡:Mg(OH)2(s)?Mg2-+2OH-,Mg(OH)2的悬浊液中加入硝酸铵溶液后,NH4+结合OH-使氢氧化镁溶解平衡正向移动溶液变澄清,
故答案为:酸;NH4++H2O?NH3?H2O+H+;存在溶解平衡:Mg(OH)2(s)?Mg2-+2OH-,Mg(OH)2的悬浊液中加入硝酸铵溶液后,NH4+结合OH-使氢氧化镁溶解平衡正向移动溶液变澄清;
(3)F为Fe元素,亚铁离子容易被氧化成铁离子,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O;可以通过检验溶液中是否还有亚铁离子判断,方法为:取待测液于试管中,滴加酸性高锰酸钾溶液,若紫色褪去,说明没有被完全氧化,
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;取待测液于试管中,滴加酸性高锰酸钾溶液,若紫色褪去,说明没有被完全氧化;
(4)E元素的最高价氧化物对应的水化物为高氯酸,D元素的最高价氧化物对应的水化物为氢氧化铝,高氯酸与氢氧化铝反应生成高氯酸钠和水,反应的化学方程式为:Al(OH)3+3HClO4=Al(ClO4)3+3H2O,
故答案为:Al(OH)3+3HClO4=Al(ClO4)3+3H2O.
(1)根据分析可知,五中元素中,金属性最强的元素为Na元素,Na的原子序数为11,在周期表中位于第三周期 IA族;D为Al元素,其原子结构示意图为:,
故答案为:第三周期 IA族;
 ;
;(2)B为N元素,N的气态氢化物为氨气,其最高价氧化物对应的水化物为硝酸,氨气与硝酸反应生成硝酸铵,由于铵根离子部分水解,溶液显示酸性,铵根离子水解的离子方程式为:NH4++H2O?NH3?H2O+H+;氢氧化镁浊液中存在溶解平衡:Mg(OH)2(s)?Mg2-+2OH-,Mg(OH)2的悬浊液中加入硝酸铵溶液后,NH4+结合OH-使氢氧化镁溶解平衡正向移动溶液变澄清,
故答案为:酸;NH4++H2O?NH3?H2O+H+;存在溶解平衡:Mg(OH)2(s)?Mg2-+2OH-,Mg(OH)2的悬浊液中加入硝酸铵溶液后,NH4+结合OH-使氢氧化镁溶解平衡正向移动溶液变澄清;
(3)F为Fe元素,亚铁离子容易被氧化成铁离子,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O;可以通过检验溶液中是否还有亚铁离子判断,方法为:取待测液于试管中,滴加酸性高锰酸钾溶液,若紫色褪去,说明没有被完全氧化,
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;取待测液于试管中,滴加酸性高锰酸钾溶液,若紫色褪去,说明没有被完全氧化;
(4)E元素的最高价氧化物对应的水化物为高氯酸,D元素的最高价氧化物对应的水化物为氢氧化铝,高氯酸与氢氧化铝反应生成高氯酸钠和水,反应的化学方程式为:Al(OH)3+3HClO4=Al(ClO4)3+3H2O,
故答案为:Al(OH)3+3HClO4=Al(ClO4)3+3H2O.
点评:本题考查了位置、结构与性质关系的综合应用,题目难度中等,正确推断各元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律之间的关系,试题知识点较多、综合性较强,充分考查了学生灵活运用基础知识的能力.

练习册系列答案
相关题目
对于可逆反应H2(g)+I2(g)?2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
| A、H2(g)的消耗速率与HI(g)的生成速率之比为2:1 |
| B、正、逆反应速率的比值是恒定的 |
| C、当HI的分子数与I2分子数之比为2:1时,说明反应达到了平衡状态 |
| D、达到平衡时,正、逆反应速率相等 |
纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液.放电时两个电极反应分别为:Zn+2OH-→Zn(OH)2+2e-Ag2O+H2O+2e-→2Ag+2OH-,下列说法正确的是( )
| A、锌是负极,氧化银是正极 |
| B、锌发生还原方应,氧化银发生氧化反应 |
| C、溶液中OH-向正极移动,K+、H+向负极移动 |
| D、在电池放电过程中,电解质溶液的酸碱性基本保持不变 |
下列实验正确的是( )
A、 蒸发、浓缩、结晶 |
B、 检查装置气密性 |
C、 碳酸氢钠受热分解 |
D、 分离沸点不同且互溶的液体混合物 |
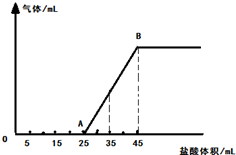 将一定量的NaOH、NaHCO3和Na2CO3三种溶液混合,向混合液中逐渐滴滴加一定浓度的稀盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示:
将一定量的NaOH、NaHCO3和Na2CO3三种溶液混合,向混合液中逐渐滴滴加一定浓度的稀盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示: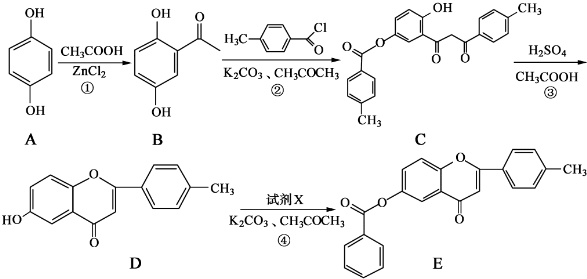

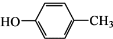 和CH3COOH为原料制备
和CH3COOH为原料制备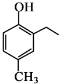 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题: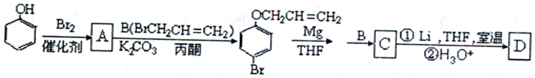
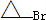 是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有
是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有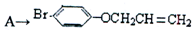 的有机反应类型
的有机反应类型