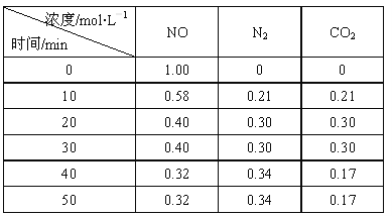
题目内容
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为________
(2)NiO、FeO的晶体结构类型均与氯化钠的相同、Fe2+和Ni2+的离子半径分别78pm和69pm,则熔点FeO________ (填“<”或“>”) NiO;
(3)[Ni(NH3)6]SO4中阴离子的立体构型是_____。氨的沸点____(填“高于”或“低于”)膦(PH3),原因是_________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的化学式为________;
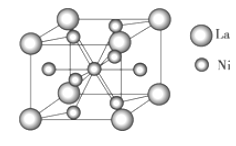
(5)某镍白铜合金的立方晶胞结构如图所示。
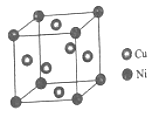
①晶胞中镍原子的堆积模型名称是_____。
②元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______
③若合金的密度为dg/cm3,晶胞参数(即边长)a =________nm
【答案】1s22s22p63s23p63d84s2或[Ar]3d84s2 < 正四面体 高于 NH3分子间可形成氢键 LaNi5 简单立方 铜失去的是全充满的3d10电子,镍失去的是4s1电子,所以ICu>INi ![]() ×107
×107
【解析】
(1)Ni原子的质子数是28,所以根据构造原理可知,Ni的基态电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,因此都是离子晶体。由于Ni2+和Fe2+的离子半径分别为69 pm和78 pm,所以NiO中晶格能强于FeO中晶格能,所以熔点FeO< NiO;
(3)[Ni(NH3)6]SO4中阴离子为SO42-,中心原子S的价层电子对数=4+![]() =4且不含孤电子对,根据价层电子对互斥理论,硫酸根离子的立体构型为正四面体;含有分子间氢键的氢化物熔沸点较高,氨气分子间含有氢键、膦(PH3)分子间没有氢键,则氨的熔沸点高于膦(PH3);
=4且不含孤电子对,根据价层电子对互斥理论,硫酸根离子的立体构型为正四面体;含有分子间氢键的氢化物熔沸点较高,氨气分子间含有氢键、膦(PH3)分子间没有氢键,则氨的熔沸点高于膦(PH3);
(4)由“均摊法”知每个晶胞中含有:一个La(8×![]() =1)、五个Ni(1+8×
=1)、五个Ni(1+8×![]() =5),故该合金的化学式为:LaNi5;
=5),故该合金的化学式为:LaNi5;
(5)①该晶胞中Ni原子个数=8×![]() =1、Cu原子个数=6×
=1、Cu原子个数=6×![]() =3,则Cu、Ni原子个数之比为3:1,晶胞中镍原子的堆积模型名称是简单立方;
=3,则Cu、Ni原子个数之比为3:1,晶胞中镍原子的堆积模型名称是简单立方;
②元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是铜失去的是全充满的3d10电子,镍失去的是4s1电子,所以ICu>INi;
③该晶胞的化学式为Cu3Ni,若合金的密度为dg/cm3,晶胞参数=![]() =
=![]() cm=
cm=![]() ×107nm。
×107nm。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案