题目内容
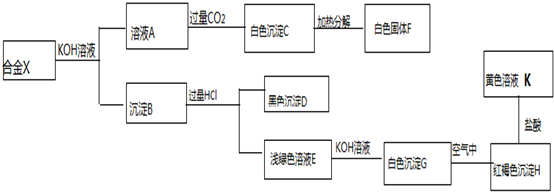
12.某化学活动小组在实验室中从海带灰浸取液获得纯碘实验方案如图所示,下列说法不正确的是( )
| A. | 步骤X中可用MnO2代替双氧水 | |
| B. | 步骤Y中所用的玻璃仪器一定有分液漏斗 | |
| C. | 步骤Y中可用酒精代替CCl4 | |
| D. | 由于碘易升华,步骤Z中不能采取加热蒸发 |
分析 海带灰浸取液中通过步骤X加入适量PH=1的过氧化氢氧化碘离子为碘单质,得到含碘单质的水溶液,加入四氯化碳振荡、静置、分液得到含碘单质的四氯化碳溶液,通过蒸馏得到碘单质,
A.二氧化锰具有氧化性可以氧化碘单质;
B.分液操作需要玻璃仪器为分液漏斗;
C.酒精易溶于水;
D.碘单质易升华,四氯化碳易挥发,加热不能分离混合物;
解答 解:A.MnO2代难溶于水,具有氧化性,可以氧化碘离子为碘单质,步骤X中可用MnO2代替双氧水,故A正确;
B.步骤Y为分液操作,需要分液漏斗,故B正确;
C.步骤Y为分液操作,酒精易溶于水在水溶液中不能分层,不能萃取碘单质,故C错误;
D.由于碘易升华,步骤Z中不能采取加热蒸发,采取的是蒸馏的操作分离得到碘单质,故D正确;
故选C.
点评 本题考查了海水中碘单质的提取实验方法和操作步骤分析判断,题目较简单.

练习册系列答案
相关题目
6.常温下有以下体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水 ④pH=4的NaOH溶液,下列说法正确的是( )
| A. | ①与②分别与足量镁粉反应,生成H2的量:①<② | |
| B. | ②和③混合,所得混合溶液的pH大于7 | |
| C. | ③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③=④ | |
| D. | 若将四种溶液稀释100倍,溶液pH大小顺序:③>④>①>② |
4.下列分子中的14个碳原子一定会处于同一平面上的是( )
| A. |  | B. |  | C. |  | D. |  |
17.下列检测方法不合理的是( )
| 实验 | 检验方法 | |
| A | 向沸水中滴加饱和FeCl3溶液,制备胶体 | 用可见光束照射 |
| B | 确认铜与浓硫酸反应生成CuSO4 | 将反应后溶液转入盛有水的烧杯中 |
| C | 区分AgNO3溶液和Al2(SO4)3溶液 | 分别取少量溶液,滴加BaCl2溶液 |
| D | 证明氯水中起漂白作用的不是Cl2 | 用CCl4充分萃取,将红纸条分别浸入分层后的溶液中 |
| A. | A | B. | B | C. | C | D. | D |
4.某学习小组通过下列装置探究MnO2与FeCl3•6H2O能否反应产生Cl2.
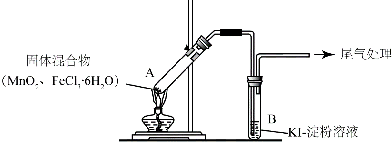
实验操作和现象:
(1)现象i 中的白雾是HCl小液滴,形成白雾的原因是FeCl3•6H2O 受热水解,生成HCl 气体,同时受热失去结晶水,HCl和H2O 结合形成盐酸小液滴.
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液检验现象ii 和a 中的黄色气体,溶液均变红.
通过该实验说明现象ii 中黄色气体含有FeCl3.
(3)除了氯气可使B 中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI-淀粉溶液,再滴入几滴HCl 溶液,在空气中放置,观察一段时间后溶液是否变蓝.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,无证实了Cl2的存在.
方案 1:在A、B 间增加盛有某种试剂的洗气瓶C.
方案 2:将B 中KI-淀粉溶液替换为NaBr 溶液;检验 Fe 2+.
现象如下:
方案1B中溶液变为蓝色
方案2B中溶液呈浅橙红色;未检出Fe 2+
①方案1 的C 中盛放的试剂是饱和NaCl 溶液.
②方案2 中检验 Fe 2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
③综合方案1、2 的现象,说明选择NaBr 溶液的依据是Br-可以被Cl2 氧化成Br2,但不会被Fe3+氧化为Br2.
(5)将A 中产物分离得到Fe2O3和MnCl2,A 中产生Cl2的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.

实验操作和现象:
| 操作 | 现象 |
| 点燃酒精灯,加热 | iA中部分固体溶解,上方出现白雾 ii稍后,产生黄色气体,管壁附着黄色液滴 iiiB中溶液变蓝 |
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液检验现象ii 和a 中的黄色气体,溶液均变红.
通过该实验说明现象ii 中黄色气体含有FeCl3.
(3)除了氯气可使B 中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI-淀粉溶液,再滴入几滴HCl 溶液,在空气中放置,观察一段时间后溶液是否变蓝.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,无证实了Cl2的存在.
方案 1:在A、B 间增加盛有某种试剂的洗气瓶C.
方案 2:将B 中KI-淀粉溶液替换为NaBr 溶液;检验 Fe 2+.
现象如下:
| 方案1 | B中溶液变为蓝色 |
| 方案2 | B中溶液呈浅橙色;未检出Fe2+ |
方案2B中溶液呈浅橙红色;未检出Fe 2+
①方案1 的C 中盛放的试剂是饱和NaCl 溶液.
②方案2 中检验 Fe 2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
③综合方案1、2 的现象,说明选择NaBr 溶液的依据是Br-可以被Cl2 氧化成Br2,但不会被Fe3+氧化为Br2.
(5)将A 中产物分离得到Fe2O3和MnCl2,A 中产生Cl2的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.