题目内容
水热法制备直径为1~100 nm的颗粒Y(化合物),反应原理为:3Fe2+ + 2S2O32- + O2 + aOH-= Y+ S4O62- + 2H2O,下列说法中不正确的是
A.a=4
B.将Y均匀分散到水中形成的体系具有丁达尔效应
C.每有3 mol Fe2+ 参加反应,反应中转移的电子总数为5 mol
D.S2O32-是还原剂
C
【解析】
试题分析:A、根据电荷守恒可知3×2-2×2-a=-2,所以a=4,正确;B、Y的直径为1~100 nm的颗粒,属于胶体,具有胶体的性质,所以将Y均匀分散到水中形成的体系具有丁达尔效应,正确;C、根据元素守恒定律,可知Y是Fe3O4,Fe、S的化合价均升高,所以氧气是氧化剂,每有3 mol Fe2+ 参加反应,消耗1mol氧气,转移电子的物质的量是4mol,错误;D、S2O32-中S的化合价是+2价,产物中S的化合价是+4价,化合价升高,作还原剂,正确,答案选C。
考点: 考查对氧化还原反应的分析,守恒规律的应用

(18分)C、O、Na、Al、S、Cl是常见的六种元素
(1)C元素位于元素周期表第 周期,第 族;C元素的一种同位素可以测定文物年代,这种同位素的符号为
(2)用“大于”“小于”或“等于”填空
离子半径 | 还原性 | 得电子能力 |
N3- Al3+ | O2- S2- | 35Cl 37Cl |
(3)① CaCO3和适量HCl溶液反应时,每产生4.4 g 气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为 。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示


请用离子方程式表示B-C段发生的反应:
(4)氢气、氧气常用来作燃料电池,写出电解质为氢氧化钠溶液时负极上的电极方程式
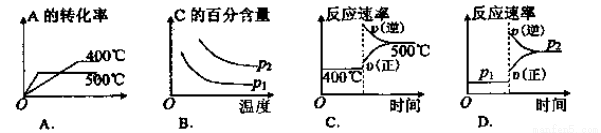
 2C(g),根据下表中的数据判断下列图像错误的是( )
2C(g),根据下表中的数据判断下列图像错误的是( )
 H2CO3 + 2OH-
H2CO3 + 2OH-