题目内容
20.用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是( )①加盐酸溶解
②加烧碱溶液溶解
③过滤
④通入过量CO2生成Al(OH)3沉淀
⑤加入盐酸生成盐胜生成Al(OH)3沉淀
⑥加入过量烧碱溶液.
| A. | ①⑥⑤③ | B. | ⑥③④③ | C. | ②③⑤③ | D. | ①③⑤③ |
分析 根据镁和铝化学性质的差异:铝可以与碱反应,让镁和铝分离的方法是使铝溶于氢氧化钠溶液,镁不溶解,过滤分离,再将偏铝酸钠与弱酸反应变为氢氧化铝.
解答 解:因镁与碱不反应,而铝可以与碱反应:2Al+2NaOH+2H2O=2NaAlO2 +3H2↑,由于镁不溶解,过滤除去,NaAlO2要转变成Al(OH)3,可以向滤液中加入过量的二氧化碳,其反应为NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓,再过滤即得纯净的Al(OH)3,实验操作最合理的组合及顺序为⑥③④③,
故选B.
点评 本题主要考查铝及其化合物的性质,难度不大,由NaAlO2制备氢氧化铝只能用弱酸不能强酸,因为强酸一旦过量,氢氧化铝会继续与强酸反应,与弱酸不反应.

练习册系列答案
相关题目
19.对下列实验过程的评价,正确的是( )
| A. | 某溶液中加入稀盐酸,产生无色气体,证明该溶液中一定有CO32- | |
| B. | 某溶液中先加少量氯化钡溶液,再加足量稀盐酸生成白色沉淀,证明该溶液中一定含有SO42- | |
| C. | 验证烧碱溶液中是否有Cl-,先加稀硝酸除去OH-,再加AgNO3溶液,有白色沉淀产生,证明有Cl- | |
| D. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 |
11.水蒸气通过炽热的炭层时,发生反应:C+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO,该反应类型属于( )
| A. | 化合反应 | B. | 置换反应 | C. | 分解反应 | D. | 复分解反应 |
8.苯环和侧链相互影响,下列关于甲苯的实验事实中,能说明侧链对苯环有影响的是( )
| A. | 甲苯能使酸性KMnO4溶液褪色 | |
| B. | 甲苯能与浓硝酸浓硫酸反应生成三硝基甲苯 | |
| C. | 甲苯能与H2发生加成反应 | |
| D. | 甲苯能萃取溴水中的溴 |
15.有Fe 2+、NO3-、Fe 3+、NH4+、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 每1 mol NO3-发生还原反应,转移6 mol e- | |
| D. | 若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+ |
5.可溶性铝盐与强碱溶液反应,铝元素的存在形式如图,则a、b的差值为( )

| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
12.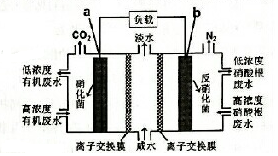 一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )
 一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )| A. | a电极为该电池的正极 | |
| B. | 电极b的反应式:2NO3--10e-+12H+=N2↑+6H2O | |
| C. | 每处理1molC8H10O5,b电极将产生3.2molN2 | |
| D. | a电极离子交换膜允许Na+白中间空迁有机废水处理室 |
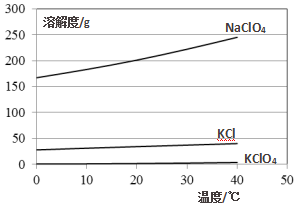 化学反应的条件多种多样,“撞击”也是其中的一种.如:NaN3、Fe2O3、KClO4、NaHCO3等组成的混合物受撞击时会产生大量气体,因而曾用作汽车安全气囊的产气药剂,其原理如下:
化学反应的条件多种多样,“撞击”也是其中的一种.如:NaN3、Fe2O3、KClO4、NaHCO3等组成的混合物受撞击时会产生大量气体,因而曾用作汽车安全气囊的产气药剂,其原理如下: