题目内容
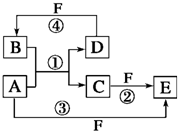
在一定条件下,单质B、C、D、E都能与A单质发生化合反应,转化关系如图1所示.已知:①G是黑色晶体,能吸附B单质;②H能与氢氧化钠溶液或盐酸反应;③实验时在G和C的混合物表面加入某强氧化剂粉末,在表面上插入一根除去氧化膜的E片,点燃E引发G与C的反应;④I是绿色植物光合作用的原料,温室中常用它作肥料.根据上述信息,回答下列问题:

(1)I的电子式为 ,G的俗名是 .
(2)以C和E为电极在NaOH溶液中构成原电池,该原电池的负极反应式为 .
(3)根据E和A反应的能量变化图象2写出热化学方程式: .
(4)两种常见含C元素的盐,一种pH>7,另一种pH<7,写出这两种溶液混合时发生反应的离子方程式: 、 .
(5)写出B在高温下和水蒸气反应的化学方程式并标出电子转移方向和总数 .

(1)I的电子式为
(2)以C和E为电极在NaOH溶液中构成原电池,该原电池的负极反应式为
(3)根据E和A反应的能量变化图象2写出热化学方程式:
(4)两种常见含C元素的盐,一种pH>7,另一种pH<7,写出这两种溶液混合时发生反应的离子方程式:
(5)写出B在高温下和水蒸气反应的化学方程式并标出电子转移方向和总数
考点:无机物的推断
专题:推断题
分析:单质B、C、D、E都能与A单质发生化合反应,①G是黑色晶体,能吸附B单质推断B为Fe,G为Fe3O4,进而得到A位O2;②H能与氢氧化钠溶液或盐酸反应说明是两性氧化物,C为单质为Al,说明H为Al2O3;③实验时在G和C的混合物表面加入某强氧化剂粉末,在表面上插入一根除去氧化膜的E片,点燃E引发G与C的反应,是铝热反应,证明E为Mg,F为MgO;④I是绿色植物光合作用的原料,温室中常用它作肥料,证明I为CO2,D为C,E+I=F发生的是2Mg+CO2=C+2MgO,根据上述信息推断出的物质分析回答问题;
(1)二氧化碳是共价化合物,碳原子和两个氧原子分别形成两个共价键;G为四氧化三铁俗称为磁性氧化物;
(2)Mg和Al在氢氧化钠溶液中形成原电池反应,负极是铝生成偏铝酸钠;
(3)依据图象分析反应的焓变,标注物质聚集状态和对应焓变写出热化学方程式;
(4)两种常见含C元素的盐为铝盐,一种pH>7为AlO2-,另一种pH<7为Al3+,铝离子水解显酸性,偏铝酸根离子水解显碱性,二者发生双水解反应生成氢氧化铝沉淀;
(1)二氧化碳是共价化合物,碳原子和两个氧原子分别形成两个共价键;G为四氧化三铁俗称为磁性氧化物;
(2)Mg和Al在氢氧化钠溶液中形成原电池反应,负极是铝生成偏铝酸钠;
(3)依据图象分析反应的焓变,标注物质聚集状态和对应焓变写出热化学方程式;
(4)两种常见含C元素的盐为铝盐,一种pH>7为AlO2-,另一种pH<7为Al3+,铝离子水解显酸性,偏铝酸根离子水解显碱性,二者发生双水解反应生成氢氧化铝沉淀;
解答:
解:单质B、C、D、E都能与A单质发生化合反应,①G是黑色晶体,能吸附B单质推断B为Fe,G为Fe3O4,进而得到A位O2;②H能与氢氧化钠溶液或盐酸反应说明是两性氧化物,C为单质为Al,说明H为Al2O3;③实验时在G和C的混合物表面加入某强氧化剂粉末,在表面上插入一根除去氧化膜的E片,点燃E引发G与C的反应,是铝热反应,证明E为Mg,F为MgO;④I是绿色植物光合作用的原料,温室中常用它作肥料,证明I为CO2,D为C,E+I=F发生的是2Mg+CO2=C+2MgO,
(1)二氧化碳是共价化合物,碳原子和两个氧原子分别形成两个共价键,电子式为: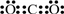 ;G为四氧化三铁俗称为磁性氧化物
;G为四氧化三铁俗称为磁性氧化物
故答案为: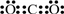 ,磁性氧化铁;
,磁性氧化铁;
(2)以C为Al和E为Mg为电极在NaOH溶液中构成原电池,铝做负极失电子发生氧化反应,碱溶液中生成偏铝酸根离子,该原电池的负极反应式为Al-3e-+4OH-=AlO2-+2H2O;
故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(3)图象分析0.2molMg和0.1molCO2反应生成0.2molC,反应放热QKJ,依据反应2Mg+CO2=C+2MgO,2molMg和1molCO2反应生成2molC放热10QKJ,依据热化学方程式书写方法写出为:2Mg(s)+O2(g)=2MgO(s)△H=-10QkJ/mol;
故答案为:2Mg(s)+O2(g)=2MgO(s)△H=-10QkJ/mol;
(4)两种常见含C元素的盐为铝盐,一种pH>7为AlO2-,另一种pH<7为Al3+,铝离子水解显酸性,偏铝酸根离子水解显碱性,二者发生双水解反应生成氢氧化铝沉淀,反应的离子方程式为3AlO2-+Al3++6H2O=4Al(OH)3↓;
故答案为:3AlO2-+Al3++6H2O=4Al(OH)3↓;
(5)B为Fe在高温下和水蒸气反应生成Fe3O4和H2,反应的化学方程式中,铁元素化合价变化升高为
价,化合价变化3×
=8,所以电子转移总数为8,标出电子转移方向和总数的化学方程式为: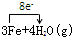
Fe3O4+4H2;
故答案为: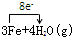
Fe3O4+4H2;
(1)二氧化碳是共价化合物,碳原子和两个氧原子分别形成两个共价键,电子式为:
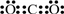 ;G为四氧化三铁俗称为磁性氧化物
;G为四氧化三铁俗称为磁性氧化物故答案为:
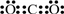 ,磁性氧化铁;
,磁性氧化铁;(2)以C为Al和E为Mg为电极在NaOH溶液中构成原电池,铝做负极失电子发生氧化反应,碱溶液中生成偏铝酸根离子,该原电池的负极反应式为Al-3e-+4OH-=AlO2-+2H2O;
故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(3)图象分析0.2molMg和0.1molCO2反应生成0.2molC,反应放热QKJ,依据反应2Mg+CO2=C+2MgO,2molMg和1molCO2反应生成2molC放热10QKJ,依据热化学方程式书写方法写出为:2Mg(s)+O2(g)=2MgO(s)△H=-10QkJ/mol;
故答案为:2Mg(s)+O2(g)=2MgO(s)△H=-10QkJ/mol;
(4)两种常见含C元素的盐为铝盐,一种pH>7为AlO2-,另一种pH<7为Al3+,铝离子水解显酸性,偏铝酸根离子水解显碱性,二者发生双水解反应生成氢氧化铝沉淀,反应的离子方程式为3AlO2-+Al3++6H2O=4Al(OH)3↓;
故答案为:3AlO2-+Al3++6H2O=4Al(OH)3↓;
(5)B为Fe在高温下和水蒸气反应生成Fe3O4和H2,反应的化学方程式中,铁元素化合价变化升高为
| 8 |
| 3 |
| 8 |
| 3 |
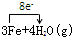
| ||
故答案为:
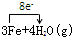
| ||
点评:本题考查了物质推断和转化关系的分析应用,主要是铝及其化合物性质的应用,注意热化学方程式书写方法,氧化还原反应电子转移数的计算和标注,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
同温同压下,体积相同的两密闭容器中分别盛有CO2和CO,两容器内的气体一定具有相同的( )
| A、原子数 | B、分子数 |
| C、O原子数 | D、质量 |
下列做法中,不利于实现让包头“天更蓝、水更清”目标的是( )
| A、任意排放污水 |
| B、推广使用脱硫煤 |
| C、减少汽车尾气排放 |
| D、推广使用无磷洗衣剂 |
 ; ⑥CH3 (CH2)3 CH3和
; ⑥CH3 (CH2)3 CH3和
 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).