题目内容
W、X、Y、Z是原子序数依次增大的同一短周期元素,W是金属元素,X是地壳中含量最多的金属元素,且W、X的最高价氧化物的水化物相互反应生成盐和水;Y、Z是非金属元素,Y与W可形成离子化合物W2Y;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子.
(1)X的原子结构示意图为 ;
(2)W、X的最高价氧化物的水化物相互反应的离子方程式为 ;
(3)工业上制取X单质的化学方程式为 ;
(4)G的气态氢化物与Y的最高价氧化物的水化物恰好反应生成的正盐溶液中,离子浓度由大到小的顺序为 ;在催化剂作用下,汽车尾气中G的氧化物GO与CO两种气体能相互反应转化为无污染、能参与大气循环的两种气体,若有33.6L(已换算成标准状况)一氧化碳参加反应,转移的电子数为 mol;
(5)298K时,Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到Z的最高价氧化物的水化物的稀溶液,并放出a kJ的热量,该反应的热化学方程式为 .
(1)X的原子结构示意图为
(2)W、X的最高价氧化物的水化物相互反应的离子方程式为
(3)工业上制取X单质的化学方程式为
(4)G的气态氢化物与Y的最高价氧化物的水化物恰好反应生成的正盐溶液中,离子浓度由大到小的顺序为
(5)298K时,Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到Z的最高价氧化物的水化物的稀溶液,并放出a kJ的热量,该反应的热化学方程式为
分析:W、X、Y、Z是原子序数依次增大的同一短周期元素,X是地壳中含量最多的金属元素,则X为Al;W是金属元素,且W、X的最高价氧化物的水化物相互反应生成盐和水,可推知W为Na;Y、Z是非金属元素,Y与W可形成离子化合物W2Y,Y为-2价,可推知Y为S,结合原子序数可知Z为Cl;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子,G原子最外层电子数=6-1=5,可推知G为N,据此解答.
解答:解:W、X、Y、Z是原子序数依次增大的同一短周期元素,X是地壳中含量最多的金属元素,则X为Al;W是金属元素,且W、X的最高价氧化物的水化物相互反应生成盐和水,可推知W为Na;Y、Z是非金属元素,Y与W可形成离子化合物W2Y,Y为-2价,可推知Y为S,结合原子序数可知Z为Cl;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子,G原子最外层电子数=6-1=5,可推知G为N,
(1)X为Al,原子核外有13的电子,其原子结构示意图为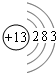 ,
,
故答案为: ;
;
(2)W、X的最高价氧化物的水化物分别为NaOH、Al(OH)3,反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(3)工业上电解熔融的氧化铝制取Al单质,化学方程式为2Al2O3(熔融)
4Al+3O2↑,
故答案为:2Al2O3(熔融)
4Al+3O2↑;
(4)G的气态氢化物为NH3,Y的最高价氧化物的水化物为H2SO4,二者恰好反应生成的正盐为(NH4)2SO4,溶液中NH4+离子水解,溶液呈酸性,水解比较微弱,故溶液浓度由大到小的顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-);在催化剂作用下,汽车尾气中的氧化物NO与CO两种气体能相互反应化为无污染、能参与大气循环的两种气体,应生成N2与CO2,33.6L(已换算成标准状况)一氧化碳参加反应,CO的物质的量=
=1.5mol,C元素化合价由+2升高为+4,故转移的电子数为1.5mol×(4-2)=3mol,
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);3;
(5)298K时,Z的最高价氧化物C12O7为无色液体,0.25mol该物质与一定量水混合得到HClO4的水化物的稀溶液,并放出a kJ的热量,则1mol Cl2O7反应放出的热量为4a kJ,故该反应的热化学方程式为:Cl2O7(l)+H2O(l)═2HClO4(aq),△H=-4akJ?mol-1,
故答案为:Cl2O7(l)+H2O(l)═2HClO4(aq),△H=-4akJ?mol-1.
(1)X为Al,原子核外有13的电子,其原子结构示意图为
 ,
,故答案为:
 ;
;(2)W、X的最高价氧化物的水化物分别为NaOH、Al(OH)3,反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(3)工业上电解熔融的氧化铝制取Al单质,化学方程式为2Al2O3(熔融)
| ||
故答案为:2Al2O3(熔融)
| ||
(4)G的气态氢化物为NH3,Y的最高价氧化物的水化物为H2SO4,二者恰好反应生成的正盐为(NH4)2SO4,溶液中NH4+离子水解,溶液呈酸性,水解比较微弱,故溶液浓度由大到小的顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-);在催化剂作用下,汽车尾气中的氧化物NO与CO两种气体能相互反应化为无污染、能参与大气循环的两种气体,应生成N2与CO2,33.6L(已换算成标准状况)一氧化碳参加反应,CO的物质的量=
| 33.6L |
| 22.4L/mol |
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);3;
(5)298K时,Z的最高价氧化物C12O7为无色液体,0.25mol该物质与一定量水混合得到HClO4的水化物的稀溶液,并放出a kJ的热量,则1mol Cl2O7反应放出的热量为4a kJ,故该反应的热化学方程式为:Cl2O7(l)+H2O(l)═2HClO4(aq),△H=-4akJ?mol-1,
故答案为:Cl2O7(l)+H2O(l)═2HClO4(aq),△H=-4akJ?mol-1.
点评:本题考查结构性质位置关系应用,涉及常用化学用语、离子浓度比较、氧化还原反应计算、热化学方程式书写等,难度中等,推断元素是解题关键,(5)中注意液体与溶液不同,学生容易忽略.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 Q、W、X、Y、Z是原子序数逐渐增大的短周期元素.已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是原子序数逐渐增大的短周期元素.已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.