题目内容
17.在图中,已知:A、B、C、D、E、F均含有同一种元素,其中A为单质,其它均为化合物.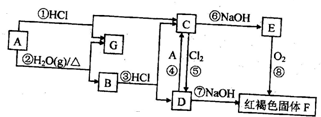
请根据图中所示的转化关系,按要求回答下列问题:
(1)写出下列物质的化学式:GH2; DFeCl3.
(2)在①-⑧的化学反应中,不属于氧化还原反应的有:③⑥⑦(填序号).
(3)写出E转化为F的过程中的变化现象:白色沉淀迅速变为灰绿色,最终变为红褐色.
(4)写出反应⑤的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
(5)写出反应③的化学方程式:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O.
(6)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用D溶液作为“腐蚀液”来“腐蚀”铜箔制成线路板.请写出相关的化学方程式:2FeCl3+Cu=2FeCl2+CuCl2.
分析 A、B、C、D、E、F均含有同一种元素,单质A与盐酸反应生成C与G,C与氢氧化钠反应生成E,E与氧气反应生成红褐色沉淀F,则A为Fe,G为 H2,C为FeCl2,E为Fe(OH)2,结合转化关系可知F为Fe(OH)3,B为Fe3O4,D为FeCl3.
解答 解:A、B、C、D、E、F均含有同一种元素,单质A与盐酸反应生成C与G,C与氢氧化钠反应生成E,E与氧气反应生成红褐色沉淀F,则A为Fe,G为 H2,C为FeCl2,E为Fe(OH)2,结合转化关系可知F为Fe(OH)3,B为Fe3O4,D为FeCl3.
(1)由上述分析可知,G为 H2,D为FeCl3,
故答案为:H2;FeCl3;
(2)在①-⑧的化学反应中,不属于氧化还原反应的有:③⑥⑦,
故答案为:③⑥⑦;
(3)E转化为F的过程中的变化现象:白色沉淀迅速变为灰绿色,最终变为红褐色,
故答案为:白色沉淀迅速变为灰绿色,最终变为红褐色;
(4)反应⑤的离子方程式:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(5)反应③的化学方程式:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,
故答案为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O;
(6)刻制印刷电路时,要用D溶液作为“腐蚀液”来“腐蚀”铜箔制成线路板.相关的化学方程式:2FeCl3+Cu=2FeCl2+CuCl2,
故答案为:2FeCl3+Cu=2FeCl2+CuCl2.
点评 本题考查无机物的推断,涉及Fe元素单质化合物性质与转化,F为红褐色固体为推断突破口,再结构转化关系推断,熟练掌握元素化合物性质,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
8.如图所示是分离混合物时常用的仪器,从左到右,可以进行的混合物分离操作方便是( )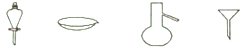
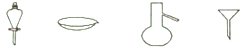
| A. | 蒸馏、蒸发、萃取、过滤 | B. | 蒸馏、过滤、萃取、蒸发 | ||
| C. | 过滤、蒸发、萃取、蒸馏 | D. | 萃取、蒸发、蒸馏、过滤 |
5.下列有关的化学史实描述错误的是( )
| A. | 中国化学家侯德榜研究了“侯氏联合制碱法”,为我国化工发展做出贡献 | |
| B. | 瑞典化学家舍勒发现软锰矿(含MnO2)与浓盐酸混合加热制得氯气 | |
| C. | 意大利物理甲阿伏伽德罗发现当光束通过胶体时可见一条光路 | |
| D. | 德国化学家哈伯在合成氨的研究中做出了巨大贡献 |
12.关于一些重要化学概念的说法:①氢氧化钠的摩尔质量为40g/mol;②用酒精做萃取剂,提取碘水中的碘;③酸雨是指pH小于5.6的降水;④氧化还原反应的本质是反应前后元素的化合价变化;⑤丁达尔效应可以区分溶液和胶体;其中正确的是( )
| A. | ①②③ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③⑤ |
2. 短周期主族元素M、N、X、W在元素周期表中的相对位置如图所示,N元素的单质常用作半导体材料.下列判断正确的是( )
短周期主族元素M、N、X、W在元素周期表中的相对位置如图所示,N元素的单质常用作半导体材料.下列判断正确的是( )
 短周期主族元素M、N、X、W在元素周期表中的相对位置如图所示,N元素的单质常用作半导体材料.下列判断正确的是( )
短周期主族元素M、N、X、W在元素周期表中的相对位置如图所示,N元素的单质常用作半导体材料.下列判断正确的是( )| A. | 原子半径的大小:W>X>M | |
| B. | 气态氢化物的稳定性:N>X>M | |
| C. | 对应的含氧酸的酸性强弱:W>X>N | |
| D. | W分别与N、X形成的化合物中的化学键均为极性键 |
 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去,再与溴水反应.请你回答下列问题:
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去,再与溴水反应.请你回答下列问题:



 某无色溶液中阴离子为Cl-,阳离子可能含有下列离子中的一种或几种:H+、K+、Al3+、NH4+、Fe3+,向该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH 溶液的体积(V)的关系如图所示.
某无色溶液中阴离子为Cl-,阳离子可能含有下列离子中的一种或几种:H+、K+、Al3+、NH4+、Fe3+,向该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH 溶液的体积(V)的关系如图所示.