题目内容
25 ℃时,水中存在电离平衡:H2O H++OH-,下列关于水的说法,不正确的是( )
H++OH-,下列关于水的说法,不正确的是( )
| A.水的电离是吸热过程 |
| B.向水中加入少量稀硫酸,c(H+)增大,KW不变 |
| C.含H+的溶液显酸性,含OH-的溶液显碱性 |
| D.水是极弱的电解质,在50 ℃时水的pH小于7 |
C
解析

练习册系列答案
相关题目
室温下,用0.100 0 mol·L-1NaOH溶液分别滴定体积均为20.00 mL的盐酸和醋酸溶液,滴定曲线如右图。下列说法正确的是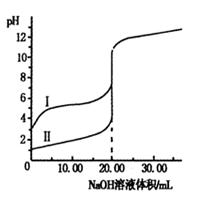
| A.I、Ⅱ分别表示盐酸和醋酸的滴定曲线 |
| B.盐酸和醋酸的浓度均为0.100 0 mol·L-1 |
| C.pH=7时,两种酸所消耗NaOH溶液的体积相等 |
| D.V(NaOH)=20.00mL时,c(Cl一)=c(CH3COO一) |
常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
| 实验编号 | c(HA)/mol·L-1 | c(NaOH)/mol·L-1 | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.2 | 0.2 | pH=9 |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
下列判断正确的是( )
A.a>9
B.在乙组混合液中由水电离出的c(OH-)=10-5mol·L-1
C.c1<0.2
D.丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-)
一定温度下,水存在H2O H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是( )
H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是( )
| A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 |
| B.将水加热,Kw增大,pH减小 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.向水中加入少量固体硫酸钠,c(H+)=10-7 mol·L-1,Kw不变 |
针对0.1 mol·L-1的醋酸溶液,下列分析判断正确的是( )
| A.升高温度,溶液的pH会增大 |
| B.加入少量固体NaOH,溶液中c(CH3COO-)+c(OH-)>c(Na+)+c(H+) |
| C.加入少量0.2 mol·L-1的硫酸溶液,水电离产生的c(H+)减小 |
| D.与0.1 mol·L-1的NaOH溶液等体积混合后,溶液中c(CH3COO-)=c(Na+) |
0.1mol·L-1HF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )
| A.c(H+)>c(F-) | B.c(H+)>c(HF) |
| C.c(OH-)<c(HF) | D.c(HF)>c(F-) |
常温下,取0.2 mol·L-1HX溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH = 8,则下列说法(或关系式)正确的是( )
| A.c(Na+)-c(X-)=9.9×10-7mol·L-1 |
| B.c(Na+)=c(X-)+c(HX)=0.2 mol·L-1 |
| C.c(OH-)-c(HX)=c(H+)=1×10-6mol·L-1 |
| D.混合溶液中由水电离出的c(OH-)=10-8mol·L-1 |
在T℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T℃),测得混合溶液的部分pH如下表所示:
| 序号 | NaOH溶液体积 | 盐酸体积 | 溶液pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为( )
A.1 B.4 C.5 D.6