题目内容
 实验室用乙醇和浓硫酸加热反应制取乙烯,其原理为:
实验室用乙醇和浓硫酸加热反应制取乙烯,其原理为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
若温度过高时,乙醇可被浓硫酸脱水炭化生成单质碳而使溶液常常变黑色,请回答下列问题:
(1)写出碳与浓硫酸反应生成二氧化硫的化学方程式
2)有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫,提供的试剂是(可重复使用)
①品红溶液 ②NaOH溶液 ③溴水
B装置中盛放的药品是
(3)D装置的作用是
考点:乙烯的实验室制法
专题:有机物的化学性质及推断
分析:(1)根据碳和浓硫酸加热反应生成二氧化硫、二氧化碳和水来书写方程式;
(2)二氧化硫的检验用品红溶液,乙烯的检验用溴水,乙烯和二氧化硫都能使溴水褪色,所以先检验二氧化硫,然后检验乙烯,在检验乙烯之前用NaOH溶液除去SO2;(3)品红溶液不褪色确认SO2已除干净;最后用溴水褪色检验乙烯;
(2)二氧化硫的检验用品红溶液,乙烯的检验用溴水,乙烯和二氧化硫都能使溴水褪色,所以先检验二氧化硫,然后检验乙烯,在检验乙烯之前用NaOH溶液除去SO2;(3)品红溶液不褪色确认SO2已除干净;最后用溴水褪色检验乙烯;
解答:
解:(1)因浓硫酸具有强氧化性,碳具有还原性,碳和浓硫酸加热反应生成二氧化硫、二氧化碳和水,所以化学方程式为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
(2)检验二氧化硫用品红溶液,检验乙烯用溴水,乙烯和二氧化硫都能使溴水褪色,所以先检验二氧化硫,然后检验乙烯,在检验乙烯之前用NaOH溶液除尽SO2,再通过品红溶液不褪色确认SO2已除干净,最后用溴水褪色检验乙烯,因装置I用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置II试管装有NaOH溶液除去SO2,
故答案为:①,②;
(3)C装置用NaOH溶液除去SO2,D装置用品红溶液确认SO2已除净,E装置用溴水褪色检验乙烯,
故答案为:验证SO2是否完全除尽;溴水褪色;
| ||
故答案为:C+2H2SO4(浓)
| ||
(2)检验二氧化硫用品红溶液,检验乙烯用溴水,乙烯和二氧化硫都能使溴水褪色,所以先检验二氧化硫,然后检验乙烯,在检验乙烯之前用NaOH溶液除尽SO2,再通过品红溶液不褪色确认SO2已除干净,最后用溴水褪色检验乙烯,因装置I用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置II试管装有NaOH溶液除去SO2,
故答案为:①,②;
(3)C装置用NaOH溶液除去SO2,D装置用品红溶液确认SO2已除净,E装置用溴水褪色检验乙烯,
故答案为:验证SO2是否完全除尽;溴水褪色;
点评:本题主要考查了实验室制乙烯以及产物的检验,当有多种产物需检验时,应考虑先后顺序,溴水既能氧化二氧化硫,又能氧化乙烯,是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
下列实验能成功的是( )
| A、将浓硫酸和乙醇混合加热140℃制乙烯 |
| B、用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热,产生砖红色沉淀 |
| C、CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 |
| D、苯和浓溴水反应制溴苯 |
下列关于元素周期律的叙述正确的是( )
| A、随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 |
| B、元素性质的周期性变化是指原子核外电子排布、原子半径及元素主要化合价的周期性变化 |
| C、随着元素原子序数的递增,原子半径从小到大(稀有气体除外)发生周期性变化 |
| D、在元素周期表中有些元素既表现出一定的金属性又表现出一定的非金属性 |
 和一个-Cl,它的可能结构分别是
和一个-Cl,它的可能结构分别是 已知实验室制取氯气是用二氧化锰和浓盐酸反应的原理,在收集时,若是用排水法,可能会损失部分氯气.
已知实验室制取氯气是用二氧化锰和浓盐酸反应的原理,在收集时,若是用排水法,可能会损失部分氯气.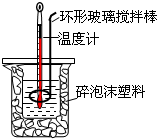 测定中和热实验装置如图:
测定中和热实验装置如图:






 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.