题目内容
 发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)电解液.镍氢电池充放电原理总反应式为:H2+2NiOOH═2Ni(OH)2.下列有关混合动力车的判断正确的是( )
发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)电解液.镍氢电池充放电原理总反应式为:H2+2NiOOH═2Ni(OH)2.下列有关混合动力车的判断正确的是( )| A、在上坡或加速时,乙电极周围溶液的pH将减小 |
| B、在上坡或加速时,溶液中的K+向甲电极迁移 |
| C、在刹车和下坡时,甲电极的电极反应式为:2H2O+2e-═H2↑+2OH- |
| D、在刹车和下坡时,乙电极增重 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、放电过程为原电池,根据乙中的电极反应来分析pH;
B、放电过程为原电池,原电池工作时,溶液中的阳离子向正极迁移;
C、电解池的阴极上水得电子发生还原反应;
D、根据电解池的工作原理知识来回答.
B、放电过程为原电池,原电池工作时,溶液中的阳离子向正极迁移;
C、电解池的阴极上水得电子发生还原反应;
D、根据电解池的工作原理知识来回答.
解答:
解:A、混合动力车上坡或加速时,属于原电池的工作原理,电动机提供推动力,是电池放电,由图转化关系可知,NiOOH转变为Ni(OH)2,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,乙电极周围因氢氧根离子的浓度增大,pH将增大,故A错误;
B、放电过程为原电池,原电池工作时,溶液中的阳离子钾离子向,正极即乙电极迁移,故B错误;
C、在刹车和下坡时电池处于充电状态即电解池的工作原理,甲电极是阴极,氢离子发生得电子发生还原反应,电极反应式为2H2O+2e-=H2↑+2OH-,故C正确;
D、在刹车和下坡时,属于电解池的工作原理,乙电极为阳极,是氢氧化镍转化为NiOOH的过程,电极质量减轻,故D错误.
故选C.
B、放电过程为原电池,原电池工作时,溶液中的阳离子钾离子向,正极即乙电极迁移,故B错误;
C、在刹车和下坡时电池处于充电状态即电解池的工作原理,甲电极是阴极,氢离子发生得电子发生还原反应,电极反应式为2H2O+2e-=H2↑+2OH-,故C正确;
D、在刹车和下坡时,属于电解池的工作原理,乙电极为阳极,是氢氧化镍转化为NiOOH的过程,电极质量减轻,故D错误.
故选C.
点评:本题考查学生原电池和电解池的工作原理知识,注意平时知识的积累以及基础知识的掌握,难度中等.

练习册系列答案
相关题目
向FeI2和FeBr2物质的量之比为1:1的混合溶液中逐滴滴入氯水,下列离子反应不可能发生的是( )
| A、2Fe2++4I-+3Cl2→2Fe3++2I2+6Cl- |
| B、2Fe2++2I-+2Cl2→2Fe3++I2+4Cl- |
| C、2Fe2++2I-+2Br-+3Cl2→2Fe3++I2+Br2+6Cl- |
| D、2Fe2++4I-+4Br-+5Cl2→2Fe3++2I2+2Br2+10Cl- |
将含amol Na2SO3的溶液与含bmol Na2S的溶液混合后,无明显现象;若加稀硫酸,则立即出现浅黄色沉淀,并有能使品红褪色的气体产生,则a与b的比值为( )
| A、大于2 | ||
| B、小于2 | ||
| C、等于2 | ||
D、大于
|
某一有机物A可发生下列变化:A(C6H12O2)
 已知c为羧酸,且.C、E均不能发生银镜反应,则A的可能结构有( )
已知c为羧酸,且.C、E均不能发生银镜反应,则A的可能结构有( )
| NaOH溶液 |
| △ |
 已知c为羧酸,且.C、E均不能发生银镜反应,则A的可能结构有( )
已知c为羧酸,且.C、E均不能发生银镜反应,则A的可能结构有( )| A、1种 | B、4种 | C、3种 | D、2种 |
如图是产生和收集气体的实验装置,该装置不适合于( )
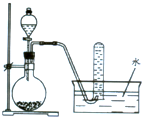

| A、用锌和盐酸制取H2 |
| B、用NH4Cl和Ca(OH)2制取NH3 |
| C、用电石和饱和食盐水制取C2H2 |
| D、用H2O2在MnO2催化下制O2 |
下列叙述正确的是( )
| A、质子数相同的微粒之间一定互为同位素 |
| B、已发现的元素有112种,因此有112种原子 |
| C、属于同位素的原子一定为同种元素 |
| D、水(H2O)和重水(D2O)互称同位素 |
锂电池是一种常用的电池,它广泛应用于心脏起搏器,一般可达十年之久,它的反应方程式为Li+MnO2═LiMnO2,下列有关它的说法错误的是( )
| A、它的负极是锂 |
| B、它的电解质溶液需用非水溶剂配制 |
| C、当有3.01×1023个电子转移时,正极消耗1mol |
| D、它是比容量(单位质量电极材料所能转换的电量)特别大的电池 |