题目内容
5.在0.1mol/L NH4Cl溶液中,离子浓度最大的是( )| A. | Cl- | B. | NH4+ | C. | H+ | D. | OH- |
分析 NH4Cl为强酸弱碱反应,铵根离子水解显酸性,以此来解答.
解答 解:NH4Cl为强酸弱碱反应,铵根离子水解显酸性,则溶液中离子浓度大小为c(Cl-)>c(NH4+)>c(H+)>c(OH-),则离子浓度最大的为Cl-,
故选A.
点评 本题考查离子浓度大小的比较,为高频考点,把握盐类水解的规律、溶液中离子、物质的构成为解答的关键,侧重分析与应用能力的考查,注意水解原理的应用,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
15.下列变化中需要加入还原剂才能发生的是( )
| A. | N2→NO | B. | N2→NH3 | C. | NO→NO2 | D. | NH3→NO |
16.下列数据是对应物质的熔点,由以下数据做出的下列判断中,错误的是( )
| 物质 | Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 熔点 | 920 | 801 | 1291 | 190 | -107 | 2073 | -57 | 1723 |
| A. | 铝的化合物的晶体中有的是分子晶体 | |
| B. | 表中只有BCl3和干冰是分子晶体 | |
| C. | 离子晶体熔化时破坏离子键 | |
| D. | 分子晶体熔化时不破坏共价键 |
10.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1 mol H3O+ 所含质子数为10NA | |
| B. | 40克氖气所含分子数约为6.02×1023 | |
| C. | 标准状况下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下32 g O2所含原子数不是2NA |
17.在下述条件下,一定能大量共存的离子组是( )
| A. | 无色透明的水溶液中:K+、Ba2+、I-、MnO4- | |
| B. | 使石蕊试液变蓝色的溶液:Mg2+、K+、SO42-、NO3- | |
| C. | 某澄清溶液中:HCO3-、Na+、Al3+、Br- | |
| D. | 常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ |
6.下列实验装置及操作不能达到实验目的是( )
| A. |  用Ca(OH)2和NH4Cl制取NH3 | B. | 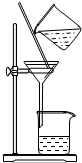 从碘水中提取碘单质 | ||
| C. | 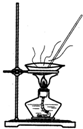 从食盐水中获取氯化钠 | D. | 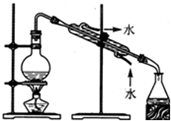 用自来水制取蒸馏水 |
7.元素的原子序数与该元素原子中哪种数据不一定相等( )
| A. | 质子数 | B. | 中子数 | C. | 核外电子数 | D. | 核电荷数 |
 A、B、C、D均为烃的衍生物,它们之间的转化关系如图所示:
A、B、C、D均为烃的衍生物,它们之间的转化关系如图所示: