题目内容
下列离子方程式一定正确的是
[ ]
A.镁与一定浓度的硝酸反应:3Mg +8H+ +2NO3-= 3Mg2+ +2NO↑+4H2O
B.纯碱的水解:CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl- Cl2↑+Mn2+ +H2O
Cl2↑+Mn2+ +H2O
D.Ca(HCO3)2溶液与澄清石灰水反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.纯碱的水解:CO32-+2H2O
 H2CO3+2OH-
H2CO3+2OH- C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-
 Cl2↑+Mn2+ +H2O
Cl2↑+Mn2+ +H2O D.Ca(HCO3)2溶液与澄清石灰水反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
D

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
 (2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
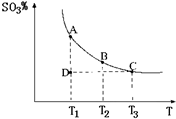
(2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义. 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:

 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答: