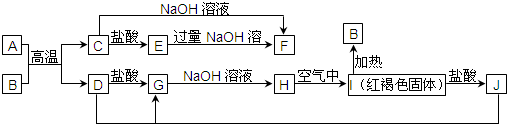
题目内容
 已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题.
已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题.(1)写出B、C的化学式:B:
(2)检验D中阳离子,常用
(3)实验室保存C溶液时为什么要加固体A?
(4)E转化为F的现象是
(5)写出下列转化的离子方程式.①A→C:
考点:无机物的推断
专题:推断题
分析:A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe,Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3,据此解答.
解答:
解:A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe,Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3,
(1)由上述分析可知,B为Fe3O4,C为FeCl2,
故答案为:Fe3O4;FeCl2;
(2)D为FeCl3,含有阳离子为Fe3+,检验Fe3+离子的方法为:取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,证明有Fe3+,
故答案为:KSCN溶液;溶液变红色;
(3)FeCl2易被空气中氧气氧化,保存FeCl2溶液时加固体Fe,防止Fe2+被氧气氧化,
故答案为:防止Fe2+被氧气氧化;
(4)E转化为F是氢氧化亚铁被氧气氧化生成氢氧化铁,现象是:白色沉淀迅速变成灰绿色,最后变成红褐色;反应化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:白色沉淀迅速变成灰绿色,最后变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)①A→C的反应离子方程式为:Fe+2H+=Fe2++H2↑,②C→D的反应离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:Fe+2H+=Fe2++H2↑;2Fe2++Cl2=2Fe3++2Cl-.
(1)由上述分析可知,B为Fe3O4,C为FeCl2,
故答案为:Fe3O4;FeCl2;
(2)D为FeCl3,含有阳离子为Fe3+,检验Fe3+离子的方法为:取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,证明有Fe3+,
故答案为:KSCN溶液;溶液变红色;
(3)FeCl2易被空气中氧气氧化,保存FeCl2溶液时加固体Fe,防止Fe2+被氧气氧化,
故答案为:防止Fe2+被氧气氧化;
(4)E转化为F是氢氧化亚铁被氧气氧化生成氢氧化铁,现象是:白色沉淀迅速变成灰绿色,最后变成红褐色;反应化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:白色沉淀迅速变成灰绿色,最后变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)①A→C的反应离子方程式为:Fe+2H+=Fe2++H2↑,②C→D的反应离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:Fe+2H+=Fe2++H2↑;2Fe2++Cl2=2Fe3++2Cl-.
点评:本题考查无机物推断,涉及Fe元素单质化合物的性质及转化,物质的颜色是推断突破口,再结合转化关系推断各物质,掌握元素化合物的性质是解题的关键.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、7.8g苯中含有0.3NA个碳碳双键,0.3NA个碳碳单键 |
| B、2L 0.1 mol/L的醋酸钠溶液中,醋酸根离子数为0.2NA |
| C、5.6g铁与足量的稀硝酸反应,失去电子数为0.2NA |
| D、SiO2晶体中,有NA个Si就有4NA个Si-O键 |
有机化学已经发展成为化学的一个重要分支,渗透到医药、国防、生产的各个角落,在研究有机物方面,化学家们不断探索,做出了不可磨灭的贡献.打破无机物和有机物界限的化学家( )
| A、贝采利乌斯 | B、维勒 |
| C、李比希 | D、海维西 |
 如图为CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液.下列说法不正确的是( )
如图为CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液.下列说法不正确的是( )| A、工作时,铜片作阴极 |
| B、工作时,K+向铜片电极移动 |
| C、工作时,铂片上的电极反应式为4OH--4e-=O2↑+2H2O |
| D、若CxHy为C2H4,则生成1 mol C2H4的同时生成2 molO2 |