题目内容
15.实验室里用加热正丁醇、溴化钠和浓硫酸的混合物的方法来制备1-溴丁烷,已知有关物质的性质如下:| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |

(1)生成1-溴丁烷的化学方程式为CH3CH2CH2CH2OH+NaBr+H2SO4$\stackrel{△}{→}$CH3CH2CH2CH2Br+NaHSO4+H2O.
(2)由于副反应的发生而可能产生的副产物有CH3CH2CH=CH2、CH3CH2CH2CH2OCH2CH2CH2CH3.(至少两种,有机物用结构简式表示)
(3)为了将反应混合物中1-溴丁烷及时分离出,应选用的装置是D(填序号),该操作应控制的温度t2范围是101.6℃≤t<117.25℃.
(4)在得到的1-溴丁烷的产物中出现了分层现象,某同学选择用分液的方法进行分离.在本实验分离过程中,产物应该从分液漏斗的下口放出(填“上口倒出”或“下口放出”).
(5)本实验所用的正丁醇质量为20.0g,最后得到纯净的1-溴丁烷的质量为22.2g,本实验的产率约是C(填正确答案标号).
A.40% B.50% C.60% D.70%
分析 (1)实验室里用加热正丁醇、溴化钠和浓硫酸的混合物生成1-溴丁烷、硫酸氢钠和水,据此书写化学方程式;
(2)正丁醇和浓硫酸在加热条件下可以发生消去反应,生成1-丁烯,也可以发生取代反应生成二丁醚等;
(3)将反应混合物中1-溴丁烷及时分离出,可以用蒸馏的方法,蒸馏时要使1-溴丁烷蒸发出去而正丁醇不能蒸发,根据题中提供的各物质的沸点可知控制的温度t2范围;
(4)1-溴丁烷的密度大于水,在下层,用分液的方法进行分离时,下层液体从下层放出,上层液体从上层倒出;
(5)根据正丁醇生成1-溴丁烷的方程式CH3CH2CH2CH2OH+NaBr+H2SO4$\stackrel{△}{→}$CH3CH2CH2CH2Br+NaHSO4+H2O可知,1mol正丁醇生成1mol1-溴丁烷,所以20.0g正丁醇理论上生成1-溴丁烷的质量为$\frac{20g}{74}×137$=37.03g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)实验室里用加热正丁醇、溴化钠和浓硫酸的混合物生成1-溴丁烷、硫酸氢钠和水,反应的化学方程式为CH3CH2CH2CH2OH+NaBr+H2SO4$\stackrel{△}{→}$CH3CH2CH2CH2Br+NaHSO4+H2O,
故答案为:CH3CH2CH2CH2OH+NaBr+H2SO4$\stackrel{△}{→}$CH3CH2CH2CH2Br+NaHSO4+H2O;
(2)正丁醇和浓硫酸在加热条件下可以发生消去反应,生成1-丁烯,也可以发生取代反应生成二丁醚等,所以副产物有CH3CH2CH=CH2、CH3CH2CH2CH2OCH2CH2CH2CH3,
故答案为:CH3CH2CH=CH2、CH3CH2CH2CH2OCH2CH2CH2CH3;
(3)将反应混合物中1-溴丁烷及时分离出,可以用蒸馏的方法,故选D,蒸馏时要使1-溴丁烷蒸发出去而正丁醇不能蒸发,根据题中提供的各物质的沸点可知控制的温度t2范围为101.6℃≤t<117.25℃,
故答案为:D;101.6℃≤t<117.25℃;
(4)1-溴丁烷的密度大于水,在下层,用分液的方法进行分离时,下层液体从下层放出,上层液体从上层倒出,所以1-溴丁烷应该从分液漏斗的下口放出,
故答案为:下口放出;
(5)根据正丁醇生成1-溴丁烷的方程式CH3CH2CH2CH2OH+NaBr+H2SO4$\stackrel{△}{→}$CH3CH2CH2CH2Br+NaHSO4+H2O可知,1mol正丁醇生成1mol1-溴丁烷,所以20.0g正丁醇理论上生成1-溴丁烷的质量为$\frac{20g}{74}×137$=37.03g,所以产率=$\frac{实际产量}{理论产量}$×100%=$\frac{22.2g}{37.03g}$×100%=60%,故选C.
点评 本题主要考查了1-溴丁烷的制取实验,混合物分离的实验操作步骤和过程分析判断,明确反应原理是解答的关键,题目难度中等.

| A. | 1 mol•L-1 | B. | 2 mol•L-1 | C. | 3 mol•L-1 | D. | 4 mol•L-1 |

| A. | 先通二氧化碳、后通氨气、效果相同 | B. | 生成1mol(NH4)2SO4至少消耗2molNH3 | ||
| C. | CO2可被循环使用 | D. | 往甲中通CO2有利于制备(NH4)2SO4 |
a.0~t1时,v正>v逆,t2时,v逆>v正
b.混合气体的密度不再改变时,Ⅰ、Ⅱ两过程达到平衡
c.t2时刻改变的条件可以是向密闭容器中加C
d.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(1)+H2O(g)△H<0
t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2( g)的物质的量随时间变化如表所示:
| 时间/min | 0 | 20 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为277.8(保留一位小数).
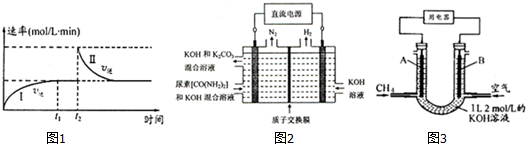
④图2所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,
(3)CH4燃料电池,装置示意如图3(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当 V=44.8L时,电池总反应方程式为CH4+2O2+KOH=KHCO3+2H2O.
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O +HCl→
+HCl→ +KCl
+KCl实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸分子量是122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,溶解 冷却、过滤, | 得到白色晶体和无色溶液 | -- |
| ② | 取少量滤液于试管中,滴入2-3滴AgNO3溶液 | 生成白色沉淀 | 滤液含有Cl- |
| ③ | 干燥白色晶体,加热使其融化,测其熔点 | 熔点为122.4℃ | 白色晶体是苯甲酸 |







