题目内容
7.一种高分子化合物(VI)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):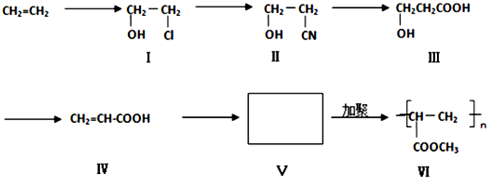
回答下列问题:
(1)目前工业上生产乙烯主要是以石油为原料通过裂解反应来实现.
(2)化合物III生成化合物IV的另外一种产物是H2O.(提示:该反应的逆反应原子利用率为100%)
(3)写出合成路线中从化合物IV到化合物VI的两步反应的化学方程式:CH2=CH-COOH+CH3OH
 CH2=CH-COOCH3+H2O、n CH2=CH-COOCH3$\stackrel{催化剂}{→}$
CH2=CH-COOCH3+H2O、n CH2=CH-COOCH3$\stackrel{催化剂}{→}$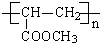 .
.(4)下列关于化合物III、IV和V的说法中,正确的是ACE(填字母)
A.化合物III可以发生氧化反应
B.化合物III不可以与NaOH 溶液反应
C.化合物IV能与氢气发生加成反应
D.化合物III、IV和V均可与金属钠反应生成氢气
E.化合物IV和V均可以使溴的四氯化碳溶液褪色.
分析 (1)工业上主要是以石油为原料通过裂解生成乙烯;
(2)化合物III生成化合物IV的反应方程式为:HOCH2CH2COOH$→_{△}^{浓硫酸}$CH2=CH-COOH+H2O;
(3)CH2=CH-COOH与CH3OH发生酯化反应生成CH2=CH-COOCH3,CH2=CH-COOCH3发生加聚反应生成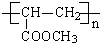 ;
;
(4)A.化合物III含有-CH2OH,可以发生氧化反应;
B.化合物III含有羧基,具有羧酸的性质;
C.化合物IV含有碳碳双键,具有烯烃的性质;
D.化合物V为CH2=CH-COOCH3,不能与金属钠反应;
E.化合物IV和V均含有碳碳双键,能与溴发生加成反应.
解答 解:(1)目前工业上生产乙烯主要是以石油为原料通过裂解反应来实现,
故答案为:石油;裂解;
(2)化合物III生成化合物IV石油消去反应,反应方程式为:HOCH2CH2COOH$→_{△}^{浓硫酸}$CH2=CH-COOH+H2O,则另外一种产物是:H2O,
故答案为:H2O;
(3)CH2=CH-COOH与CH3OH发生酯化反应生成CH2=CH-COOCH3,反应方程式为:CH2=CH-COOH+CH3OH CH2=CH-COOCH3+H2O,
CH2=CH-COOCH3+H2O,
CH2=CH-COOCH3发生加聚反应生成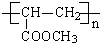 ,反应方程式为:n CH2=CH-COOCH3$\stackrel{催化剂}{→}$
,反应方程式为:n CH2=CH-COOCH3$\stackrel{催化剂}{→}$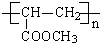 ,
,
故答案为:CH2=CH-COOH+CH3OH CH2=CH-COOCH3+H2O;
CH2=CH-COOCH3+H2O;
n CH2=CH-COOCH3$\stackrel{催化剂}{→}$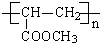 ;
;
(4)A.化合物III含有-CH2OH,可以发生氧化反应,故A正确;
B.化合物III含有羧基,具有酸性,可以与NaOH 溶液发生中和反应,故B错误;
C.化合物IV含有碳碳双键,能与氢气发生加成反应,故C正确;
D.化合物Ⅴ中不含有-OH或-COOH,不能与金属钠反应生成氢气,故D错误;
E.化合物IV和V均含有碳碳双键,能与溴发生加成反应而使溴的四氯化碳溶液褪色,故E正确.
故选:ACE.
点评 本题考查有机物的合成、有机物的结构与性质,熟练掌握官能团的性质与转化,是对有机化学基础的综合考查,题目难度不大,有利于基础知识的巩固.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H=-24.8kJ/mol.
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H=-47.2kJ/mol.
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H=+640.5kJ/mol.
则7g CO气体还原足量FeO固体得到固体Fe和CO2气体时,对应的△H为( )
| A. | +54.5 kJ/mol | B. | -218 kJ/mol | C. | -54.5 kJ/mol | D. | +218 kJ/mol |
| A. | 铜粉 | B. | 醋酸锌溶液 | C. | 氯化铜固体 | D. | 二氧化锰 |
| A. | 氢气的热值高,无污染,是一种有待开发的“绿色能源” | |
| B. | 乙醇可以直接作为燃料,也可以和汽油混合作为发动机燃料 | |
| C. | 煤的气化和液化,即可以减少污染又可以提高燃烧的热效率 | |
| D. | 甲醇燃料电池不能得到推广应用,是由于能量转化率低 |
| A. | 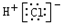 | |
| B. | NH4Br的电子式: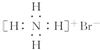 | |
| C. | N2的结构式: | |
| D. | 原子核内有18个中子的氯原子:3517Cl |
| A. | CH2═CH2+CH3COOOH(过氧乙酸)→ +CH3COOH +CH3COOH | |
| B. | CH2═CH2+Cl2+Ca(OH)2→ +CaCl2+H2O +CaCl2+H2O | |
| C. | 2CH2═CH2+O2$\stackrel{催化剂}{→}$2 | |
| D. | 3CH2OHCH2OH$\stackrel{催化剂}{→}$HOCH2CH2-O-CH2CH2OH+ +2H2O +2H2O |
| A. | 1:1 | B. | 2:3 | C. | 1:2 | D. | 2:1 |

 +CO2+H2O→NaHCO3+
+CO2+H2O→NaHCO3+ .
.