题目内容
【题目】硫酸工业中,作为催化剂的V2O5对反应Ⅰ的催化过程经历了Ⅱ、Ⅲ两个反应阶段,如图1: 
(1)下列分子中1mol化学键断裂时需要吸收的能量数据如表:
化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
能量/kJ | 535 | 472 | 496 |
则反应I的△H=kJ/mol.反应Ⅲ的化学方程式为 .
(2)从废钒催化剂中回收V2O5的过程如图2: 
①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式 .
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为[25℃,Ksp(NH4VO3)=1.6×10﹣3 , 溶液体积变化忽略不计].
(3)采用脱硫脱硝技术,同时吸收SO2和NOx , 获得(NH4)2SO4的稀溶液. ①向此溶液稀溶液中再加入少量(NH4)2SO4固体, ![]() 将(填“变大”、“不变”或“变小”).
将(填“变大”、“不变”或“变小”).
②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则 ![]() =(用含a的代数式表示,NH3H2O的Kb=1.7×10﹣5)
=(用含a的代数式表示,NH3H2O的Kb=1.7×10﹣5)
【答案】
(1)﹣98;2V2O4?SO3+O2?2V2O5+2SO3
(2)V4++H2O=VO2++2H+;0.8mol?L﹣1
(3)变大;1.7×10(9﹣a)
【解析】解:(1)反应热等于反应物的总键能减生成物的总键能,反应I的热化学反应方程式为SO2(g)+ ![]() O2(g)=SO3(g)△H,则反应I的△H=(2×535+
O2(g)=SO3(g)△H,则反应I的△H=(2×535+ ![]() ×496﹣3×472)kJ/mol=﹣98kJ/mol;V2O5在反应中作催化剂,反应Ⅱ生成V2O4SO3 , V2O5参加反应,方程式为SO2+V2O5V2O4SO3 , 反应Ⅲ是V2O4SO3与氧气反应生成V2O5和SO3反应Ⅱ生成V2O4SO3 , 方程式为2V2O4SO3+O22V2O5+2SO3 , 所以答案是:﹣98;2V2O4SO3+O22V2O5+2SO3;(2)①水解生成VO2+ , V的化合价为+4价,可由V5+水解生成,方程式为V4++H2O=VO2++2H+ , 所以答案是:V4++H2O=VO2++2H+;②溶液中c(VO3﹣)=0.1mol/L,为使钒元素的沉淀率达到98%,则沉淀后c(VO3﹣)=0.002mol/L,由Ksp(NH4VO3)=1.6×10﹣3可知c(NH4+)=
×496﹣3×472)kJ/mol=﹣98kJ/mol;V2O5在反应中作催化剂,反应Ⅱ生成V2O4SO3 , V2O5参加反应,方程式为SO2+V2O5V2O4SO3 , 反应Ⅲ是V2O4SO3与氧气反应生成V2O5和SO3反应Ⅱ生成V2O4SO3 , 方程式为2V2O4SO3+O22V2O5+2SO3 , 所以答案是:﹣98;2V2O4SO3+O22V2O5+2SO3;(2)①水解生成VO2+ , V的化合价为+4价,可由V5+水解生成,方程式为V4++H2O=VO2++2H+ , 所以答案是:V4++H2O=VO2++2H+;②溶液中c(VO3﹣)=0.1mol/L,为使钒元素的沉淀率达到98%,则沉淀后c(VO3﹣)=0.002mol/L,由Ksp(NH4VO3)=1.6×10﹣3可知c(NH4+)= ![]() mol/L=0.8mol/L,所以答案是:0.8mol/L;(3)①在(NH4)2SO4溶液中存在水解反应,NH4++H2ONH3H2O+H+ , 往(NH4)2SO4溶液中再加入少量 (NH4)2SO4固体,水解平衡向正方向进行,但铵根的水解率减小,所以
mol/L=0.8mol/L,所以答案是:0.8mol/L;(3)①在(NH4)2SO4溶液中存在水解反应,NH4++H2ONH3H2O+H+ , 往(NH4)2SO4溶液中再加入少量 (NH4)2SO4固体,水解平衡向正方向进行,但铵根的水解率减小,所以 ![]() 的值将变大,所以答案是:变大;②水解平衡常数Kh=
的值将变大,所以答案是:变大;②水解平衡常数Kh= ![]() =
= ![]()
![]() =
= ![]() ,pH=a,c(H+)=1×10﹣a , 则
,pH=a,c(H+)=1×10﹣a , 则 ![]() =
= ![]() =
= ![]() =10﹣a×
=10﹣a× ![]() =1.7×10(9﹣a) , 所以答案是:1.7×10(9﹣a) .
=1.7×10(9﹣a) , 所以答案是:1.7×10(9﹣a) .
【考点精析】关于本题考查的反应热和焓变,需要了解在化学反应中放出或吸收的热量,通常叫反应热才能得出正确答案.

 高中必刷题系列答案
高中必刷题系列答案【题目】利用如图所示装置,采用适当试剂可完成下表的探究实验,并得出相应的实验结论,其中错误的是
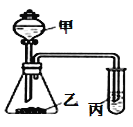
选项 | 甲 | 乙 | __丙 | 装置丙中的现象 | 实验结论 |
A | 稀硝酸 | 碳酸钾 | 澄淸石灰水 | 变浑浊 | 酸性:HNO3>H2CO3 |
B | 稀硫酸 | 碳酸钠 | 次氯酸钙溶液 | 白色沉淀 | 酸性:H2CO3>HClO |
C | 浓盐酸 | 大理石 | 硅酸钠溶液 | 白色沉淀 | 非金属性:C>Si |
D | 浓盐酸 | 高锰酸钾 | 石蕊溶液 | 先变红后褪色 | 氯水既有酸性,又具有漂白性 |
A. A B. B C. C D. D