题目内容
13.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{放电}^{充电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述错误的是( )| A. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 放电时每转移3 mol 电子,正极有1 mol K2FeO4被氧化 | |
| C. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO${\;}_{4}^{2-}$+4H2O | |
| D. | 充电时阴极附近溶液的碱性增强 |
分析 高铁电池放电时,锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,高铁酸钠在正极得到电子,电极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,充电时为电解池,阴极、阳极电极反应式与负极、正极反应式正好相反,据此分析解答.
解答 解:A.放电时,锌失电子发生氧化反应,电极反应式为Zn-2e-+2OH-=Zn(OH)2,故A正确;
B.该电池反应式中,Fe元素化合价由+6价变为+3价,所以每转移3 mol 电子,正极有1 mol K2FeO4被还原,故B错误;
C.充电时,阳极上氢氧化铁失电子发生氧化反应,所以阳极反应式为Fe(OH)3-3e-+5OH-═FeO42+4H2O,故C正确;
D.充电时阴极反应式为Zn(OH)2+2e-=Zn+2OH-,有氢氧根离子生成,所以溶液碱性增强,故D正确;
故选B.
点评 本题考查化学电源新型电池,为高频考点,会根据元素化合价变化确定各个电极上发生的反应,难点是电极反应式的书写,易错选项是B.

练习册系列答案
相关题目
1.不能由醛或酮加氢还原制得的醇是( )
| A. | 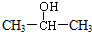 | B. | CH3CH2CH2OH | C. | 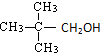 | D. | 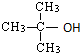 |
18.从化学角度分析,生活中的下列做法不正确的是( )
| A. | 用温水泡加酶洗衣粉 | |
| B. | 长期保存食用油应隔绝空气 | |
| C. | 使用加碘(KIO3)食盐时避免高温 | |
| D. | 可以在装饰材料中大量添加甲醛、苯等物质 |
5.吸烟者从烟中吸入的主要毒素有CO、致癌物烟焦油,还有( )
| A. | 尼古丁 | B. | CO2 | C. | H2S | D. | NH3 |
2.在恒温、恒容下,当反应容器内总压强不随时间变化时,下列可逆反应一定达到平衡的( )
| A. | 3M(气)+2N(气)?P(气)+4Q(气) | B. | M(气)+2N(气)?3P(气)+Q(固) | ||
| C. | M(气)+N(气)?P(气) | D. | 以上都达到平衡 |
4. 用一带静电的玻璃棒靠近A、B两种纯液体流,现象如图所示据此分析,A、B两种液体分子的极性正确的是( )
用一带静电的玻璃棒靠近A、B两种纯液体流,现象如图所示据此分析,A、B两种液体分子的极性正确的是( )
 用一带静电的玻璃棒靠近A、B两种纯液体流,现象如图所示据此分析,A、B两种液体分子的极性正确的是( )
用一带静电的玻璃棒靠近A、B两种纯液体流,现象如图所示据此分析,A、B两种液体分子的极性正确的是( )| A. | A是极性分子,B是非极性分子 | B. | A是非极性分子,B是极性分子 | ||
| C. | A、B都是极性分子 | D. | A、B都是非极性分子 |
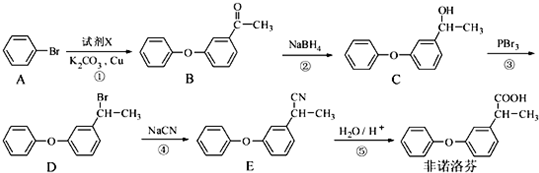
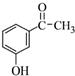 .
.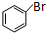 +2NaOH$\stackrel{一定条件}{→}$
+2NaOH$\stackrel{一定条件}{→}$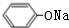 +NaBr+H2O.
+NaBr+H2O.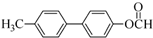 .
.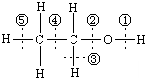 图为乙醇分子的化学键示意图,请按要求回答问题:
图为乙醇分子的化学键示意图,请按要求回答问题: