题目内容
9.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与11.2L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入2mol•L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )| A. | 2L | B. | 1 L | C. | 0.5L | D. | 3L |
分析 向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由电荷守恒可知,Cu提供电子物质的量等于氢氧化铜中氢氧根的物质的量,生成NO2、N2O4、NO 的混合气体与2.24L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,据此计算n(NaOH),进而计算消耗氢氧化钠溶液体积.
解答 解:生成NO2、N2O4、NO的混合气体与11.2L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,即Cu提供电子为$\frac{11.2L}{22.4L/mol}$×4=2mol,则Cu的物质的量为$\frac{2mol}{(2-0)}$=1mol;
向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由电荷守恒可知,Cu提供电子物质的量等于氢氧化铜中氢氧根的物质的量,故n(NaOH)=2mol,故消耗氢氧化钠溶液体积为$\frac{2mol}{2mol/L}$=1L,
故选B.
点评 本题考查氧化还原的计算,为高频考点,把握电子守恒或原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度中等.

练习册系列答案
相关题目
16.对于反应H2(g)+I2(g)?2HI(g),能量变化如图所示,下列说法不正确的是( )

| A. | 该反应是放热反应 | B. | 升高温度平衡向逆反应方向移动 | ||
| C. | 增大压强,平衡不发生移动 | D. | 升高温度,反应的平衡常数K增大 |
20.下图是四种常见有机物的比例模型示意图.下列说法不正确的是( )
| A. |  不能使酸性高锰酸钾溶液褪色 | |
| B. |  可与溴水发生取代反应而使溴水褪色 | |
| C. |  中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键 | |
| D. |  在浓硫酸作用下可与乙酸发生酯化反应 |
17.下列有关化学与自然的开发利用描述中不正确的是( )
| A. | 可用热分解法冶炼氧化汞得到水银 | |
| B. | 从自然界中提炼金属要经过矿石的富集、冶炼、精炼三步 | |
| C. | 铝热法炼铁的反应需要高温的条件,所以是吸热反应 | |
| D. | 金属单质被发现和应用得越早,其活动性一般越弱 |
4.下列变化中不能用电化学知识解释的是( )
| A. | 轮船外壳焊接锌块以防止船体锈蚀 | |
| B. | 红热铁丝浸入冷水中,表面形成蓝黑色保护层 | |
| C. | 锌与稀硫酸反应时加入少量硫酸铜溶液使反应速率加快 | |
| D. | 切过泡菜而未清洗的菜刀表面很快出现红褐色锈斑 |
14.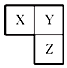 X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层 电子数是次外层电子数的3倍,下列说法正确的是( )
X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层 电子数是次外层电子数的3倍,下列说法正确的是( )
 X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层 电子数是次外层电子数的3倍,下列说法正确的是( )
X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层 电子数是次外层电子数的3倍,下列说法正确的是( )| A. | 在三种元素形成的简单气态氢化物中,Y的气态氢化物沸点最高 | |
| B. | Z元素的氧化物对应的水化物一定是一种强酸 | |
| C. | 三种元素原子半径的大小顺序为:X>Y>Z | |
| D. | Z的单质与Fe反应生成的化合物中,铁元素显+3价 |
1.仪器名称是“锥形瓶”的是( )
| A. |  | B. |  | C. |  | D. |  |
18.2016年诺贝尔化学奖授予在合成分子机器领域做出贡献的三位科学家.分子机器是一种特殊的超分子体系,当体系受到外在刺激(如pH 变化、吸收光子、电子得失等)时,分子组分间原有作用被破坏,各组分间发生类似于机械运动的某种热运动.下列说法不正确的是( )
| A. | 驱动分子机器时,需要对体系输入一定的能量 | |
| B. | 分子状态的改变会伴随能量变化,属于化学变化 | |
| C. | 氧化还原反应有可能是刺激分子机器体系的因素之一 | |
| D. | 光照有可能使分子产生类似于机械运动的某种热运动 |
6.下列有机物水解时,键断裂(用虚线表示)错误的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |