题目内容
设NA为阿伏加德罗常数,下列说法中正确的是( )
| A、同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
| B、常温常压下,17g甲基(-CH3)所含电子数为10NA |
| C、在密闭容器中,0.1mol O2和0.2mol SO2在催化剂作用下充分反应生成SO3的分子数为0.2NA |
| D、标况下,22.4L丙烷中共价键数目为10NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、氢气和氦气分子组成不同,氢气是双原子分子,氦气是单原子分子;
B、依据n=
计算物质的量,结合微粒计算电子数;
C、二氧化硫和氧气反应生成三氧化硫是可逆反应不能进行彻底;
D、依据n=
计算物质的量,结合丙烷分子结构计算共价键数.
B、依据n=
| m |
| M |
C、二氧化硫和氧气反应生成三氧化硫是可逆反应不能进行彻底;
D、依据n=
| V |
| 22.4 |
解答:
解:A、氢气和氦气分子组成不同,氢气是双原子分子,氦气是单原子分子,同温同压下,原子数均为NA的氢气和氦气具有的体积不相同,故A错误;
B、依据n=
计算物质的量=
,结合微粒计算电子数=
×9×NA=10.02NA,故B错误;
C、二氧化硫和氧气反应生成三氧化硫是可逆反应不能进行彻底,在密闭容器中,0.1mol O2和0.2mol SO2在催化剂作用下充分反应生成SO3的分子数小于0.2NA,故C错误
D、依据n=
计算物质的量=
=1mol,结合丙烷分子结构计算共价键数=1mol×(3-1+8)×NA=10NA,故D正确;
故选D.
B、依据n=
| m |
| M |
| 17g |
| 15g/mol |
| 17 |
| 15 |
C、二氧化硫和氧气反应生成三氧化硫是可逆反应不能进行彻底,在密闭容器中,0.1mol O2和0.2mol SO2在催化剂作用下充分反应生成SO3的分子数小于0.2NA,故C错误
D、依据n=
| V |
| 22.4 |
| 22.4L |
| 22.4L/mol |
故选D.
点评:本题考查了阿伏伽德罗常数的分析判断,主要是阿伏伽德罗定律的应用,质量、物质的量计算微粒数,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列反应离子方程式正确的是( )
| A、溴化亚铁溶液中通入过量氯气:Fe2++2Br-+2Cl2=Fe3++Br2+4Cl- |
| B、氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O |
| C、向澄清石灰水中加入少量小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| D、氨水中通入过量二氧化硫:2NH3?H2O+SO2=2NH4++SO32-+2H2O |
圆底烧瓶中加入的反应物是溴化钠、乙醇和1:1的硫酸.配制体积比1:1的硫酸所用的定量仪器为 ( )(选填编号).
| A、天平 | B、量筒 |
| C、容量瓶 | D、滴定管. |
下列叙述正确的是( )
| A、将FeCl3溶液加热蒸干得到FeCl3固体 |
| B、向Fe(NO3)2溶液中加少量盐酸,无明显现象 |
| C、向氢氧化镁悬浊液中滴加FeCl3溶液,无明显现象 |
| D、向 FeSO4溶液中滴加NaOH溶液,先出现白色沉淀,最终沉淀转化成红褐色 |
下列说法中正确的是( )
| A、随原子序数的递增,第三周期元素的电负性逐渐减小 |
| B、在所有的元素中,氟的电负性最大 |
| C、在所有的元素中,氟的第一电离能最大 |
| D、铝的第一电离能比镁的第一电离能大 |
下列物质分类正确的是( )
| A、SO2能与碱反应生成盐和水,属于酸性氧化物 |
| B、Cu(OH)2难溶于水,属于非电解质 |
| C、NH4Cl组成中不含金属离子,不属于盐 |
| D、HCl气体溶于水电离成H+和Cl-,属于离子化合物 |
下列分子中,各原子均处于同一平面上的是( )
| A、NH3 |
| B、CCl4 |
| C、SO32- |
| D、CH2O |
在乙酸乙酯、乙醇、乙酸水溶液共存的化学平衡体系中加入含重氢的水,经过足够长的时间后,可以发现,除水外体系中含重氢的化合物是( )
| A、只有乙醇 |
| B、乙酸、乙醇 |
| C、只有乙酸乙酯 |
| D、乙酸乙酯、乙醇、乙酸 |
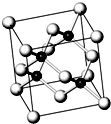 砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.已知砷化镓的晶胞结构如图.试回答下列问题:
砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.已知砷化镓的晶胞结构如图.试回答下列问题: