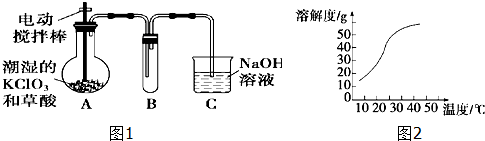
题目内容
5.分子式为C3H6O且能使溴水褪色的有机物有( )种.| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
分析 溴水具有强氧化性,可与醛等具有还原性的物质发生氧化还原反应,可与含碳碳双键或碳碳三键的有机物发生加成反应,以此解答该题.
解答 解:分子式为C3H6O的不饱和度=$\frac{3×2+2-6}{2}$=1,即含有1个碳碳双键,或者含有醛基,若含有碳碳双键,则为醇类,丙烯中含有3种化学环境不同的H,故此时有3种醇,若为醛,则只能为丙醛,故选B.
点评 本题考查有机物的结构与性质,为高频考点,侧重不饱和烃性质的考查,把握物质的成分及碳碳双键、醛的性质为解答的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列说法或表示法正确的是( )
| A. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)═C(金刚石)△H>0,可知金刚石比石墨稳定 | |
| C. | 在稀溶液 中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
16.下列说法中错误的是( )
| A. | 在Na2S溶液中滴入酚酞试液,呈红色 | |
| B. | 升高温度能使FeCl3溶液中的H+浓度增大 | |
| C. | 一切钾盐、钠盐、硝酸盐都不发生水解 | |
| D. | 醋酸盐溶于水能发生水解 |
13.下列物质中属于碱性氧化物的是( )
| A. | CO2 | B. | Na2O | C. | Na2O2 | D. | FeSO4 |
20.甘氨酸和丙氨酸以1:1的配比两两缩合后,得到的产物可能是( )


| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ①②③④⑤ |
3.阅读下表中短周期主族元素的相关信息.
请回答:
(1)写出E在元素周期表中的位置:第二周期第ⅣA族;C与D形成的化合物类型是共价化合物(离子化合物、共价化合物)
(2)写出A2B2晶体中存在的化学键:离子键、共价键.
(3)A在真空、高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称.写出Y的电子式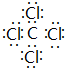 ,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
(4)常温下,0.1mol•L-1 X溶液的pH>7(填“>”“=”或“<”).简述X可以做家用消毒剂的理由:ClO-+H2O?HClO+OH-.(用化学方程式表示)
(5)写出A2B2和EB2反应的化学方程式:2Na2O2+2CO2═2Na2CO3+O2. 指出氧化剂是Na2O2、还原剂是Na2O2.
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是常用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
(1)写出E在元素周期表中的位置:第二周期第ⅣA族;C与D形成的化合物类型是共价化合物(离子化合物、共价化合物)
(2)写出A2B2晶体中存在的化学键:离子键、共价键.
(3)A在真空、高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称.写出Y的电子式
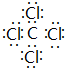 ,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.(4)常温下,0.1mol•L-1 X溶液的pH>7(填“>”“=”或“<”).简述X可以做家用消毒剂的理由:ClO-+H2O?HClO+OH-.(用化学方程式表示)
(5)写出A2B2和EB2反应的化学方程式:2Na2O2+2CO2═2Na2CO3+O2. 指出氧化剂是Na2O2、还原剂是Na2O2.