题目内容
化合物A(C12H16O2)经碱性水解、酸化后得到B和C(C8H8O2)。C中含有苯环,且苯环上有2种氢原子。B经过下列反应后得到G,G由碳、氢、氧三种元素组成,相对分子质量为172,元素分析表明,含碳55.8%,含氢7.0 %,核磁共振氢谱显示只有一个峰。

请回答下列问题:
(1)A的结构简式为_______________,G的分子式为______________。
(2)B的名称为_____________,D中官能团的名称为________________。
(3)写出F→G的化学方程式:________________________________,该反应属于_________(填反应类型)。
(4)写出满足下列条件的C的3种同分异构体的结构简式:___________________。
①是苯的对位二取代化合物;②能与FeCl3溶液发生显色反应;③不考虑烯醇( )结构。
)结构。
(5)在G的粗产物中,经检测含有聚合物杂质。写出聚合物杂质可能的结构简式(写出1种即可):_________________________________________________________________。
(1) 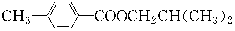 C8H12O4
C8H12O4
(2)2?甲基?1?丙醇 羧基
 取代反应(或酯化反应)
取代反应(或酯化反应)
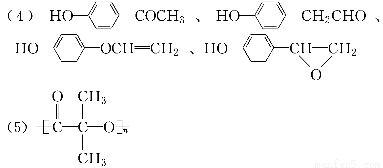
【解析】从题中转化关系可知A为酯,A(C12H16O2)+H2O―→B+C(C8H8O2),则B的分子式为C4H10O,故B为C4H9OH,B经连续氧化生成酸(D);根据信息可知,E为卤代烃,E经水解、酸化后所得的F中含有羟基和羧基。由G的组成可知,G的分子式为C8H12O4,因G分子中只有一种氢,则为F发生分子间酯化反应,形成环状酯,故F、G的结构简式为(CH3)2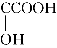 、
、 。(4)因C分子中含有苯环,且苯环上有2种氢原子,故C为对甲基苯甲酸。信息②说明C的同分异构体的苯环上的一个取代基为酚羟基,则另一取代基含两个碳原子、一个氧原子,并且不饱和度为1。(5)F发生分子间酯化反应可生成高分子化合物。
。(4)因C分子中含有苯环,且苯环上有2种氢原子,故C为对甲基苯甲酸。信息②说明C的同分异构体的苯环上的一个取代基为酚羟基,则另一取代基含两个碳原子、一个氧原子,并且不饱和度为1。(5)F发生分子间酯化反应可生成高分子化合物。

某小组取一定质量的FeSO4固体,利用下图装置进行实验。

实验 | 实验过程 | 实现现象 |
① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8 ℃。
(1)实验③反应的离子方程式是_____________________________________________。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有________气体,依据是____________________________________________________
(3)实验④反应的离子方程式是_____________________________________________。
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,并说明原因:____________________________________________(用必要的文字和化学方程式解释)。
相同温度下,体积均为0. 25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体 系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是( )
A.容器①②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量小于23.15 kJ