题目内容
常温下,如果取0.1mol?L-1 HA溶液与0.1mol?L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因: (用离子方程式表示).
(2)混合溶液中由水电离出的c(OH-) (填“>”、“<”或“=”)0.1mol?L-1 NaOH溶液中由水电离出的c(OH-).
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)= mol?L-1,c(OH-)-c(HA)= mol?L-1.
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“>”、“<”或“=”)
(1)混合溶液的pH=8的原因:
(2)混合溶液中由水电离出的c(OH-)
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)=
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:常温下,等物质的量的HA和NaOH恰好反应生成NaA,混合溶液呈碱性,说明NaA为强碱弱酸盐,
(1)弱酸根离子水解导致NaA溶液呈碱性;
(2)混合溶液中水电离出的c(OH-)=
、NaOH溶液中由水电离出的c(OH-)=c(H+);
(3)溶液中存在电荷守恒、质子守恒,根据电荷守恒、质子守恒计算;
(4)NH4A溶液为中性,说明HA电离程度和一水合氨电离程度相等,HA溶液加到Na2CO3溶液中有气体放出,说明HA酸性大于碳酸,据此判断(NH4)2CO3溶液酸碱性.
(1)弱酸根离子水解导致NaA溶液呈碱性;
(2)混合溶液中水电离出的c(OH-)=
| Kw |
| c(H+) |
(3)溶液中存在电荷守恒、质子守恒,根据电荷守恒、质子守恒计算;
(4)NH4A溶液为中性,说明HA电离程度和一水合氨电离程度相等,HA溶液加到Na2CO3溶液中有气体放出,说明HA酸性大于碳酸,据此判断(NH4)2CO3溶液酸碱性.
解答:
解:常温下,等物质的量的HA和NaOH恰好反应生成NaA,混合溶液呈碱性,说明NaA为强碱弱酸盐,则HA为弱酸,
(1)A-水解导致NaA溶液呈碱性,水解方程式为A-+H2O?HA+OH-,故答案为:A-+H2O?HA+OH-;
(2)混合溶液中水电离出的c(OH-)=
=
mol/L=10-6mol/L、NaOH溶液中由水电离出的c(OH-)=c(H+)=
mol/L=10-13mol/L,所以混合溶液中由水电离出的c(OH-)>0.1mol?L-1 NaOH溶液中由水电离出的c(OH-);
故答案为:>;
(3)溶液中存在电荷守恒,根据电荷守恒得c(Na+)-c(A-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L=0.99×10-6mol/L,根据质子守恒得c(HA)+c(H+)=c(OH-),则c(OH-)-c(HA)=c(H+)=10-8mol/L,
故答案为:0.99×10-6 ;10-8;
(4)NH4A溶液为中性,说明HA电离程度和一水合氨电离程度相等,HA溶液加到Na2CO3溶液中有气体放出,说明HA酸性大于碳酸,即HA电离程度大于碳酸,所以铵根离子水解程度小于弱酸根离子,溶液呈碱性,则pH>7,
故答案为:>.
(1)A-水解导致NaA溶液呈碱性,水解方程式为A-+H2O?HA+OH-,故答案为:A-+H2O?HA+OH-;
(2)混合溶液中水电离出的c(OH-)=
| Kw |
| c(H+) |
| 10-14 |
| 10-8 |
| 10-14 |
| 0.1 |
故答案为:>;
(3)溶液中存在电荷守恒,根据电荷守恒得c(Na+)-c(A-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L=0.99×10-6mol/L,根据质子守恒得c(HA)+c(H+)=c(OH-),则c(OH-)-c(HA)=c(H+)=10-8mol/L,
故答案为:0.99×10-6 ;10-8;
(4)NH4A溶液为中性,说明HA电离程度和一水合氨电离程度相等,HA溶液加到Na2CO3溶液中有气体放出,说明HA酸性大于碳酸,即HA电离程度大于碳酸,所以铵根离子水解程度小于弱酸根离子,溶液呈碱性,则pH>7,
故答案为:>.
点评:本题考查弱电解质电离,根据弱电解质电离特点结合电荷守恒、质子守恒分析解答,难点是碱溶液中水电离出c(OH-)或酸溶液中水电离出的c(H+)计算方法,为易错点.

练习册系列答案
相关题目
近年来我国大部分地区出现雾霾天气,造成雾霾天气主要因素是( )
| A、SO2 |
| B、NO2 |
| C、PM2.5 |
| D、CO2 |
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示:请回答下列问题:
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示:请回答下列问题:
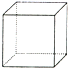 “立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.
“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示. 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题: