题目内容
(14分)如下图中A~J分别代表有关反应中的一种中学化学常见单质或化合物,其中B、C、D、I均为无色气体,G为白色沉淀。(部分产物和反应条件已略去)

(1)若A加热后得到等物质的量的B和C,则A的化学式为 。
(2)实验室检验B的方法是 。
(3)写出上述由I生成J的化学方程式: 。
(4)写出C和少量Na[Al(OH)4]溶液反应的离子方程式: 。
(5)若实验室要制备纯净的物质C(可含水蒸气)所需试剂最好选择 (填代号)。
A.石灰石
B.稀硝酸
C.稀硫酸
D.稀盐酸
E.纯碱
所需气体发生装置是 (填代号);所选装置中涉及的玻璃仪器的名称为________________________。

(14分) (1) NH4HCO3
(2)用蘸有浓盐酸的玻璃棒靠近,若出现白烟,证明是NH3
或用湿润的红色石蕊试纸靠近,若试纸变蓝,证明是NH3
(3)4NO+3O2+2H2O 4HNO3
4HNO3
(4)CO2+[Al(OH)4]- Al(OH)3↓+ HCO3-
Al(OH)3↓+ HCO3-
(5)C、E A 分液漏斗、圆底烧瓶
【解析】
试题分析:根据流程图可知,G是C与四羟基合铝酸根离子反应生成的沉淀,所以G是氢氧化铝沉淀;C是二氧化碳;二氧化碳与过氧化钠反应生成碳酸钠和氧气,所以D是氧气,E是碳酸钠;A加热得到气体的混合物,其中含有二氧化碳,则A是碳酸盐或碳酸氢盐,根据所学知识,碳酸铵或碳酸氢铵分解产生的产物全部是气体,所以A是碳酸氢铵或碳酸铵;则B是氨气,氨气与氧气发生催化氧化得到NO和水,所以I是NO,H是水,NO、水、氧气发生反应生成硝酸,所以J为硝酸,硝酸与碳酸钠反应也可生成碳酸氢钠,则F是碳酸氢钠,符合少量四羟基合铝酸根离子与二氧化碳反应的产物。
(1)A加热后得到等物质的量的B和C,则A 是碳酸氢铵,化学式为NH4HCO3;
(2)B是氨气,实验室检验B的方法是用蘸有浓盐酸的玻璃棒靠近,若出现白烟,证明是NH3;
或用湿润的红色石蕊试纸靠近,若试纸变蓝,证明是NH3;
(3)NO、水、氧气发生反应生成硝酸,化学方程式为4NO+3O2+2H2O 4HNO3;
4HNO3;
(4)二氧化碳和少量Na[Al(OH)4]溶液反应,生成氢氧化铝沉淀和碳酸氢根离子,离子方程式是CO2+[Al(OH)4]- Al(OH)3↓+ HCO3-;
Al(OH)3↓+ HCO3-;
(5)若实验室要制备纯净的物质二氧化碳(可含水蒸气)所需试剂最好选择稀硫酸和碳酸钠,因为盐酸易挥发,制取的二氧化碳气体中易混有HCl,所以选择稀硫酸,而稀硫酸与石灰石反应生成的硫酸钙微溶,附着在石灰石表面,反应速率减慢,所以不能选择石灰石,因此答案选CE;制取二氧化碳属于固液制取气体不需加热的装置,所以选择A装置,不选择C装置是因为碳酸钠为粉末状固体,启普发生器不能起到即关即停的目的;A装置中的仪器名称为分液漏斗、圆底烧瓶。
考点:考查物质的推断,氨气的检验,性质的应用,实验装置的选择,离子方程式的书写

(16分)草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一) 探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:
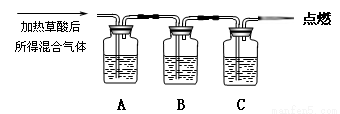
A、乙醇 B、 C、NaOH溶液。
(1)B中盛装的试剂 (填化学式)
(2)A中加入乙醇的目的是 。
(二) 探究草酸的酸性
将0.01mol草酸晶体(H2C2O4·2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是 (用离子方程式表示)。
(三) 用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理: MnO4- + H2C2O4 + = Mn2+ + CO2↑+ H2O
(1)配平上述离子方程式。
(2)滴定时KMnO4溶液应盛装于 (填 “酸式”或“碱式”)滴定管中。
Ⅱ、探究影响化学反应速率的因素
实验组别 | c(H2C2O4) /(mol/L) | V(H2C2O4) /ml | c(KMnO4) /(mol/L) | V(KMnO4) /ml | c(H2SO4) /(mol/L) | 褪色所需时间 | 实验 目的 |
1 | 0.2 | 2 | 0.0025 | 4 | 0.12 | 6'55'' | (a) |
0.2 | 2 | 0.005 | 4 | 0.12 | 5'17'' | ||
0.2 | 2 | 0.01 | 4 | 0.12 | 3'20'' | ||
0.2 | 2 | 0.02 | 4 | 0.12 | 9'05'' | ||
0.2 | 2 | 0.03 | 4 | 0.12 | 11'33'' | ||
0.2 | 2 | 0.04 | 4 | 0.12 | 14'20'' |
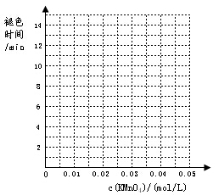
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是 ;
(2)根据表中数据在坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图像;
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是 。

 2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是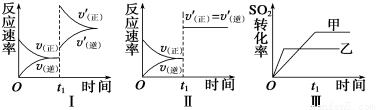
 A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响