题目内容
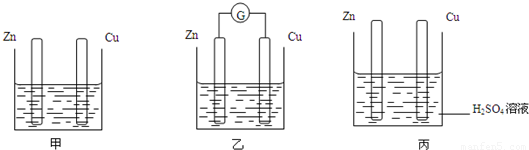
分别按如图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题: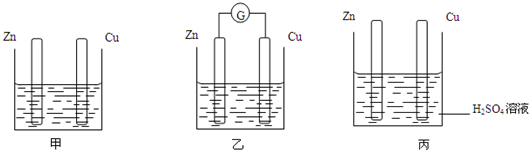
(1)以下叙述中,正确的是
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:
(5)如果要使甲装置中的铜片溶解而锌片不溶解,请在图丙中完成实验装置图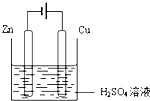
 .
.

(1)以下叙述中,正确的是
CD
CD
.A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为
化学能转化为热能
化学能转化为热能
;乙为化学能转化为电能
化学能转化为电能
.(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是
锌片不纯,在锌片上就形成原电池
锌片不纯,在锌片上就形成原电池
.(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:
Cu2++2e-=Cu
Cu2++2e-=Cu
.(5)如果要使甲装置中的铜片溶解而锌片不溶解,请在图丙中完成实验装置图


分析:(1)原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应;
(2)原电池是将化学能转变为电能,化学反应是将电能转化为热能;
(3)原电池正极上氢离子放电生成氢气;
(4)如果电解质溶液是硫酸铜溶液,铜电极上铜离子得电子发生还原反应;
(5)不能自发发生氧化还原反应的装置可以设计成电解池.
(2)原电池是将化学能转变为电能,化学反应是将电能转化为热能;
(3)原电池正极上氢离子放电生成氢气;
(4)如果电解质溶液是硫酸铜溶液,铜电极上铜离子得电子发生还原反应;
(5)不能自发发生氧化还原反应的装置可以设计成电解池.
解答:解:(1)A.甲不能构成原电池,只有锌和稀硫酸发生氧化还原反应,乙池中能构成原电池,锌作负极,铜作正极,故A错误;
B.甲池中不能构成原电池,所以甲池中铜电极上没有气泡产生,故B错误;
C.两烧杯中都是氢离子得电子生成氢气,锌失电子发生氧化反应,所以溶液的pH均增大,故C正确;
D.能形成原电池的加快反应速率,所以产生气泡的速度甲中比乙中慢,故D正确;
E.乙的外电路中电流方向Cu→Zn,故E错误;
故选CD;
(2)甲中不能形成原电池,所以是将化学能转变为热能,乙池能构成原电池,所以是将化学能转化为电能,故答案为:化学能转化为热能;化学能转化为电能;
(3)锌片有气泡产生说明锌片不纯,锌和锌片中的杂质构成原电池,杂质作正极,氢离子在杂质上得电子生成氢气,故答案为:锌片不纯,在锌片上就形成原电池;
(4)如果将稀硫酸换成硫酸铜溶液,则正极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(5)不能自发发生氧化还原反应的装置可以设计成电解池,将铜作阳极,锌作阴极,阳极上铜失电子发生氧化反应,其图象为: ,
,
故答案为: .
.
B.甲池中不能构成原电池,所以甲池中铜电极上没有气泡产生,故B错误;
C.两烧杯中都是氢离子得电子生成氢气,锌失电子发生氧化反应,所以溶液的pH均增大,故C正确;
D.能形成原电池的加快反应速率,所以产生气泡的速度甲中比乙中慢,故D正确;
E.乙的外电路中电流方向Cu→Zn,故E错误;
故选CD;
(2)甲中不能形成原电池,所以是将化学能转变为热能,乙池能构成原电池,所以是将化学能转化为电能,故答案为:化学能转化为热能;化学能转化为电能;
(3)锌片有气泡产生说明锌片不纯,锌和锌片中的杂质构成原电池,杂质作正极,氢离子在杂质上得电子生成氢气,故答案为:锌片不纯,在锌片上就形成原电池;
(4)如果将稀硫酸换成硫酸铜溶液,则正极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(5)不能自发发生氧化还原反应的装置可以设计成电解池,将铜作阳极,锌作阴极,阳极上铜失电子发生氧化反应,其图象为:
 ,
,故答案为:
 .
.点评:本题考查了原电池和电解池原理,知道原电池的构成条件,注意构成原电池的化学反应必须是自发进行的氧化还原反的放热反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
| |||||||||||||||||||||||||||||