题目内容
4.下列各图象的说法中正确的是( )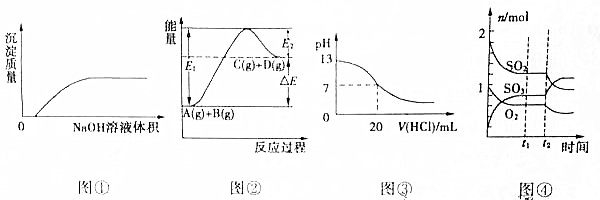
| A. | 图①表示将NaOH溶液滴入Ba(HCO3)2溶液中 | |
| B. | 图②表示反应物的总键能小于生成物的总键能 | |
| C. | 图③表示25℃时,0.1mol/L盐酸滴入20mL0.1mol/LNaOH溶液中,溶液的pH随加入酸体积的变化曲线 | |
| D. | 图④表示一定条件下的反应2SO2(g)+O2?2SO3(g)△H<0,t2时刻改变的曲线 |
分析 A.氢氧化钠与碳酸氢钡反应生成碳酸钡和碳酸钠;
B.图②表示反应物总能量低于生成物总能量,为吸热反应;
C.20mL0.1mol/LNaOH溶液PH为13,加入盐酸发生反应生成氯化钠,1mol盐酸消耗1mol氢氧化钠据此解答;
D.反应中转化量之比等于计量系数之比;
解答 解:A.氢氧化钠与碳酸氢钡反应生成碳酸钡和碳酸钠,加入氢氧化钠立刻产生沉淀,故A错误;
B.图②表示反应物总能量低于生成物总能量,为吸热反应,吸热反应断键吸收能量大于成键释放能量,故B错误;
C.20mL0.1mol/LNaOH溶液PH为13,加入盐酸发生反应生成氯化钠,1mol盐酸消耗1mol氢氧化钠,当加入0.1mol/L盐酸20mL,恰好中和,溶液呈中性,继续滴加盐酸,溶液显酸性pH减小,故C正确;
D.由图④可知时,0-t1时,二氧化硫、三氧化硫变化量为3mol,氧气变化量为2mol,二氧化硫、氧气、三氧化硫三者转化量之比为3:2:3,与方程式计量系数不成比例,故D错误;
故选:C.
点评 本题为图象题,明确物质之间发生的反应,反应热效应与反应物、生成物总能量之间的关系、影响平衡的因素是解题关键,题目难度中等.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
14.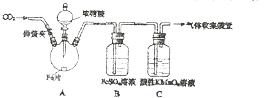 甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.
甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.
文献记载:Ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,气生成的产物有有+4、+2、-3价等氮的化合物.
Ⅱ.FeSO4+NO?Fe(NO)SO4(棕色)△H<0
Ⅲ.NO2和NO都能被KMnO4氧化吸收
甲的实验操作和现象记录如下:
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生.
(2)检验是否生成-3价氮的化合物,应进行的实验操作是取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口.若试纸变蓝,则A中生成NH4+.
(3)甲取少量B中溶液,加热,实验现象是棕色溶液变浅(或绿),无色气体逸出,且在空气中变为红棕色.甲依据该现象得出的结论是A中有NO生成.请用化学平衡原料解释原因:FeSO4+NO?Fe(NO)SO4(棕色)△H<0正反应放热,加热后,平衡向逆反应方向移动.
(4)乙认为甲得出A中有NO生成的证据不足.为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是浓硝酸换成稀硝酸,此时A中首先发生反应的离子方程式是Fe+4H++NO3-═Fe3++NO↑+2H2O,证明有NO生成的实验现象是A中没有红棕色气体生成,B中溶液变为棕色.
(5)证明A溶液中是否含有Fe2+和Fe3+,选择的药品是(填序号)cd.
a.铁粉 b.溴水 c.铁氰化钾溶液 d.硫氰化钾溶液.
 甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.
甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.文献记载:Ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,气生成的产物有有+4、+2、-3价等氮的化合物.
Ⅱ.FeSO4+NO?Fe(NO)SO4(棕色)△H<0
Ⅲ.NO2和NO都能被KMnO4氧化吸收
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | / |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余 |
(1)滴入浓硝酸加热前没有明显现象的原因是常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生.
(2)检验是否生成-3价氮的化合物,应进行的实验操作是取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口.若试纸变蓝,则A中生成NH4+.
(3)甲取少量B中溶液,加热,实验现象是棕色溶液变浅(或绿),无色气体逸出,且在空气中变为红棕色.甲依据该现象得出的结论是A中有NO生成.请用化学平衡原料解释原因:FeSO4+NO?Fe(NO)SO4(棕色)△H<0正反应放热,加热后,平衡向逆反应方向移动.
(4)乙认为甲得出A中有NO生成的证据不足.为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是浓硝酸换成稀硝酸,此时A中首先发生反应的离子方程式是Fe+4H++NO3-═Fe3++NO↑+2H2O,证明有NO生成的实验现象是A中没有红棕色气体生成,B中溶液变为棕色.
(5)证明A溶液中是否含有Fe2+和Fe3+,选择的药品是(填序号)cd.
a.铁粉 b.溴水 c.铁氰化钾溶液 d.硫氰化钾溶液.
15.下列字母表示短周期中几种元素的位置,请回答下列问题.
(1)D2-的离子结构示意图为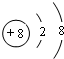 ,E与I形成的化合物的电子式为
,E与I形成的化合物的电子式为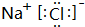 .
.
(2)E,G,H三元素的最高价氧化物对应水化物的溶液间相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,Al(OH)3+3H+=Al3++3H2O,OH-+H+=H2O.
(3)F和I形成的化合物中存在的化学键类型是离子键,在A~I九种元素中,完全由非金属元素形成的一个离子化合物的化学式是NH4NO3.
(4)4.8g单质F能与标准状况下2.24L的B的最高价氧化物恰好反应.
| A | |||||||
| B | C | D | |||||
| E | F | G | H | I | |||
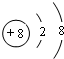 ,E与I形成的化合物的电子式为
,E与I形成的化合物的电子式为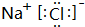 .
.(2)E,G,H三元素的最高价氧化物对应水化物的溶液间相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,Al(OH)3+3H+=Al3++3H2O,OH-+H+=H2O.
(3)F和I形成的化合物中存在的化学键类型是离子键,在A~I九种元素中,完全由非金属元素形成的一个离子化合物的化学式是NH4NO3.
(4)4.8g单质F能与标准状况下2.24L的B的最高价氧化物恰好反应.
12.某两种气态烃组成的混合物,取其2.24L(标准状况下)充分燃烧,得到0.16mol二氧化碳气体和3.6g液态水.据此判断下列分析中不正确的是( )
| A. | 此混合气体中可能含有乙烷 | |
| B. | 此气体中一定含有甲烷 | |
| C. | 此混合气体中一定不含有丙烷 | |
| D. | 此气体若是乙烯与甲烷的混合气体,则甲烷与乙烯的体积比为2:3 |
19.短周期元素H、X、Y、Z在周期表中的相对位置如图所示.已知X的最高正价和最低负价的代数和为0,下列推断正确的是( )
| X | Y | ||
| H | Z |
| A. | 常温下,含H的两种离子都能使水电离出的c•(H+)•c(OH-)增大 | |
| B. | Y的简单氢化物和Y的最高价含氧酸之间能发生氧化还原反应 | |
| C. | X的气态氢化物的热稳定性比Y的气态氢化物的热稳定性强 | |
| D. | 简单离子半径的大小顺序为H>Z>Y |
17.下列分子中,属于非极性分子的是( )
| A. | SO2 | B. | BeCl2 | C. | CH3Cl | D. | COCl2 |
18.下列说法中,不正确的是( )
| A. | 干冰升华,克服的是CO2的分子间作用力 | |
| B. | 碳原子间连接方式的多样性,是含碳化合物种类繁多的原因之一 | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | NH4Cl属于离子化合物,该物质中存在离子键和共价键 |
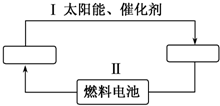 能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.
能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.