题目内容
(8分)二甲酸钾是一种白色晶体,商品名为弗米(Formil),是一种能替代抗生素的促生长剂,化学式为KH(HCOO)2,具有吸湿性,易溶于水。
二甲酸钾的生产工艺流程如下:

(1)写出甲酸和碳酸钾生产二甲酸钾的化学方程式: 。
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL。
①加入的指示剂是 (选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是 。
②上述弗米产品中二甲酸钾的质量分数为 。
⑴4HCOOH+K2CO3=2KH(HCOO)2+CO2↑+H2O(2分)
⑵①酚酞(2分)溶液由无色恰好变成浅红色且在半分钟内不褪色(2分)
②96.2%(2分)
【解析】
试题分析:(1)甲酸与碳酸钾反应生成二甲酸钾酸式盐,根据质量守恒定律,产物中还有二氧化碳、水,所以化学方程式为4HCOOH+K2CO3=2KH(HCOO)2+CO2↑+H2O;
(2)①终点时氢氧化钠与二甲酸钾恰好完全反应生成正盐,甲酸是弱酸,所以其正盐水解溶液为碱性,故使用在碱性条件下变色的酚酞做指示剂;终点的现象是溶液由无色恰好变成浅红色且在半分钟内不褪色;
②二甲酸钾与氢氧化钠溶液反应的化学方程式为2KH(HCOO)2+ 2NaOH=K2(HCOO)2 +Na2(HCOO)2+2H2O,则n(KH(HCOO)2)= n(NaOH)= 18.50×10-3L×0.10mol/L=1.85×10-3mol,所以
产品中二甲酸钾的质量分数为1.85×10-3mol×130g/mol×10÷2.5g×100%=96.2%。
考点:考查化学反应的判断,质量分数的计算,滴定实验现象的判断及指示剂的选择

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案下表中关于物质分类的正确组合是
类别组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO | CuO | H2SO4 | NH3·H2O | Na2S |
B | CO2 | Na2O | HCl | NaOH | NaCl |
C | SO2 | Na2O2 | CH3COOH | KOH | CaF2 |
D | NO2 | CaO | HNO3 | Cu(OH)2CO3 | CaCO3 |
 I2(g)+H2(g)在密闭容器中进行,当下列中的四项中的某项不随时间变化时,不能说明反应达到平衡的是
I2(g)+H2(g)在密闭容器中进行,当下列中的四项中的某项不随时间变化时,不能说明反应达到平衡的是
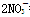 ===3Fe2++2NO↑+4H2O
===3Fe2++2NO↑+4H2O