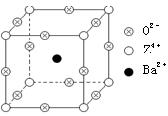
题目内容
Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子层结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物,其固态属于____________晶体,俗名为____________。
(2)R的氢化物分子的空间构型是____________;属于________分子(填“极性”或“非极性”)它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是____________。
(3)X的常见氢化物的空间构型是____________;它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是____________。
(4)Q分别与Y、Z形成的共价化合物的化学式是________________和________________;Q与Y形成的分子的电子式是____________,属于____________分子(填“极性”或“非极性”)。
(1)分子 干冰
(2)正四面体 非极性 Si3N4
(3)三角锥形 
(4)CS2 CCl4  非极性
非极性
解析

练习册系列答案
相关题目
关于晶体的叙述中,正确的是
| A.原子晶体中,共价键的键能越大,熔、沸点越高 |
| B.分子晶体中,分子间的作用力越大,该分子越稳定 |
| C.分子晶体中,共价键的键能越大,熔、沸点越高 |
| D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体 |
下面有关晶体的叙述中,错误的是( )
| A.金刚石网状结构中,碳原子和共价键的个数比为1:2 |
| B.氯化钠晶体中,每个Na+周围距离相等的Cl-肯定为6个 |
| C.氯化铯晶体中,每个Cs+周围紧邻6个Cs+ |
| D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
Ⅰ下列描述中正确的是( )
| A.CS2为V形的极性分子 |
B.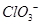 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.SF6中有6对完全相同的成键电子对 |
D.SiF4和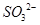 的中心原子均为sp3杂化 的中心原子均为sp3杂化 |
(1)Ni原子的核外电子排布式为__________________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,
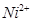 和
和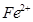 的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);(3)NiO晶胞中Ni和O的配位数分别为_________________、_________________;
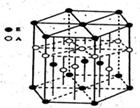
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_________________;

(5)丁二酮肟常用于检验
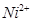 :在稀氨水介质中,丁二酮肟与
:在稀氨水介质中,丁二酮肟与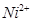 反应可生成鲜红色沉淀,其结构如右上图所示。
反应可生成鲜红色沉淀,其结构如右上图所示。①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是_________________。氮镍之间形成的化学键是_________________;
②该结构中,氧氢之间除共价键外还可存在_________________键;
③该结构中,碳原子的杂化轨道类型有_________________。
下列变化中属于吸热反应的是
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释
④氯酸钾分解制氧气 ⑤生石灰与水反应生成熟石灰
| A.③④ | B.②③ | C.①④⑤ | D.②④ |